“Ферменти в медицині, харчовій промисловості і сільському господарстві”.
Київ, 1968р.
Ф.І. Комаров
Р.Ф. Коровін
В.В. Меншиков
“Біологічні обстеження в клініці” – 1981р. – Ленінград.
Проф. М.А. Базарнова
Проф. В.Т. Морозова
“Клінічна біохімія”
Київ, 1986р.
Ссылка http://ua.textreferat.com/referat-15828.html
ГРУПОВА ТА ПРОСТОРОВА СПЕЦИФІЧНІСТЬ
Вивчення специфічності і каталітичної дії ферментів дало можливість встановити, що субстрат зв’язується не з усією молекулою ферменту, а з окремою її ділянкою, яка називається активним центром. Оскільки активний центр визначає специфічність і каталітичну активність ферменту, то він повинен складатися із структури певного ступеня складності, яка може зближуватися і взаємодіяти з молекулою субстрату.
У складних ферментах (протеїдах) активний центр утворений кофактором і залишками амінокислот; у простих ферментах (протеїнах) активний центр представлений певною комбінацією залишків амінокислот, які розміщені на відповідній ділянці молекули ферменту. До складу активного центру більшості простих ферментів входять залишки амінокислот цистеїну, серину, аргініну, аспарагінової і глутамінової кислот, гістидину, тирозину і триптофану Серед них важливе значення мають групи НS (цистеіну), групи ОН (серину), імідазольне кільце гістидину. Певну роль відіграють функціональні групи інших залишків амінокислот, зокрема карбоксильні групи аспарагінової і глутамінової кислот та індольпа група триптофану. При цьому необхідно зауважити, що такі функціональні групи розміщені в поліпептидних ланцюгах ферменту па різній відстані одна від одної. їх зближення з утворенням активного центру відбувається тільки внаслідок формування властивої для ферменту вторинної і третинної структур. Отже, активний центр ферменту складається із функціональних груп, які відповідно зорієнтовані у просторі. Порушення третинної і вторинної структур призводить до зниження або повної втрати активності ферменту. Це можна спостерігати при дії на ферменти високої температури, тобто коли відбувається їх денатурація, яка супроводжується деформацією структури білка.
Деякі ферменти мають два і більше активних центри. В активному центрі відрізняють так звану каталітичну ділянку, яка безпосередньо взаємодіє з субстратом, і контактну (якірну) ділянку, яка зумовлює спорідненість до субстрату і формування його комплексу з ферментом.
Такий поділ активного центру ферменту є досить умовним, оскільки взаємодія в контактній ділянці фермент-субстратних сполук значною мірою впливає на швидкість перетворень, які відбуваються на каталітичній ділянці ферменту. Умовний характер має також і саме відділення активного центру від інших частин ферменту, оскільки вони мають важливе значення в утворенні його нативної структури і впливають на реакційну здатність функціональних груп активного центру. Отже, за каталітичну активність ферменту відповідає вся структура його молекули.
Крім активного центру в молекулі.ферменту може бути також ало-стеричний центр (центри) (від грец алос— другий, інший і етєреос — просторовий, структурний). Алостеричний центр — це ділянка молекули ферменту, яка в результаті приєднання до неї низькомолекулярної сполуки зумовлює зміну просторової (третинної), а іноді і четвертинної структури ферменту. Це, в свою чергу, призводить до зміни конфігурації активного центру, що зумовлює зміну каталітичної активності, тобто підвищує або знижує каталітичну активність. Цей процес є основою так званої алостеричної регуляції ферментативної активності Ферменти, активність яких контролюється станом активного та алостеричного центрів, називаються алое/перинними ферментами Характерною особливістю цих ферментів є наявність у мотс-кулі олігомерного ферменту декількох активних і алостеричних центрів Функціональна активність цих центрів тісно взаємозв’язана між собою і структурою усієї молекули ферменту.
(ссылка) http://orbk.net/2009/12/specifichnist-di%D1%97-fermentiv
На окремих етапах окислення енергія, укладена в поживних речовинах, вивільняється в основному маленькими порціями і може запасатися уфосфатних зв'язках АТФ. У цьому беруть участь чудові ферменти, якісполучають окислювальні реакції (що дають енергію) з реакціями освіти АТФ (запасающими енергію). Цей процес сполучення відомий як окислювальнефосфорилування. Не будь сполучених ферментативних реакцій, життя у відомих нам формах була б неможлива.
Ферменти виконують і безліч інших функцій. Вони каталізують різноманітні реакції синтезу, включаючи освіту тканинних білків, жирів і вуглеводів. Длясинтезу всієї величезної безлічі хімічних сполук, виявлених в складнихорганізмах, використовуються цілі ферментні системи. Для цього потрібнаенергія, і в усіх випадках її джерелом служать фосфорильовані сполуки, такі, якАТФ.
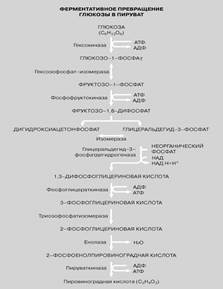

(ссылка)http://www.krugosvet.ru/enc/nauka_i_tehnika/biologiya/FERMENTI.html?page=0,2
 2015-06-26
2015-06-26 579
579







