Одной из важнейших характеристик любой структуры является координационное число. Координационное число r равно числу ближайших соседей, окружающих данный атом. В структуре NaCl r = 6, т.к. каждый атом хлора окружен шестью ионами Na, а каждый ион Na окружен шестью ионами Сl.
Для описания структуры кристаллов широко применяется метод упаковки шаров, в котором атомы или ионы представляют в виде несжимаемых шаров, между которыми действуют силы притяжения. Структуру кристаллов рассматривают как пространственную упаковку таких шаров.
Под коэффициентом упаковки f, или компактностью решетки, понимают отношение объема, занимаемого шарами в элементарной ячейке, ко всему объему элементарной ячейки.
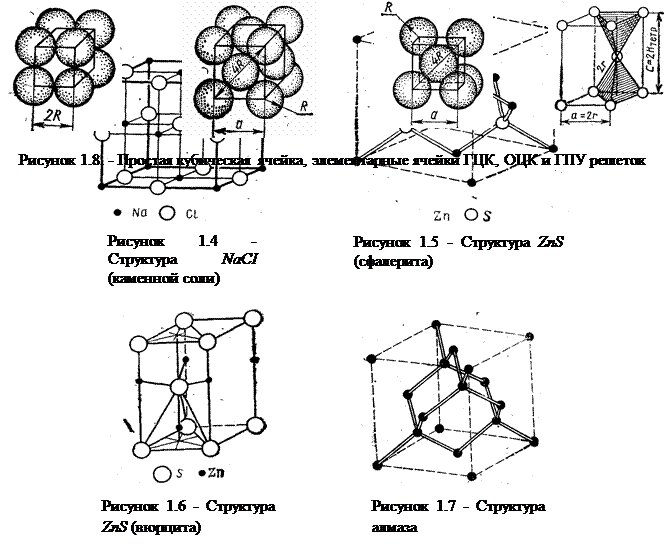
Наиболее плотной упаковке шаров отвечают гранецентрированная кубическая (ГЦК) и гексагональная плотнейшая (ГПУ) решетки, поэтому значение f = 0,74, характерное для этих решеток, является наивысшим значением коэффициента упаковки. Эти решетки составляют основу строения большинства кристаллических твердых тел. Многие кристаллы имеют также объемноцентрированную кубическую решетку (ОЦК), для которой значение коэффициента упаковки равно f = 0,68. Примеры распространенных кристаллических структур приведены на рисунках 1.4 – 1.7. На рисунке 1.8 показаны типы кристаллических решеток с помощью метода упаковки шаров.
Для гексагональной плотнейшей упаковки характерным является отношение параметров решетки
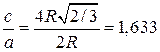 .
.
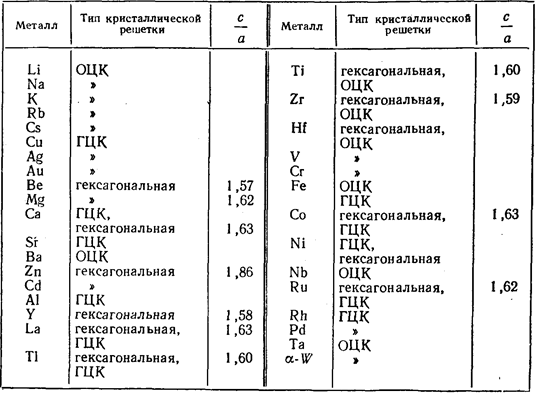
В реальных кристаллах это отношение несколько отличается от теоретического значения (см. таблицу 1.2)
По типу гексагональной плотнейшей упаковки кристаллизуются многие металлы (Be, Cd, Hf, Mg, Os, Ti, Zn, Zr и др.)
Таблица 1.2 - Металлы с гексагональной, ГЦК- и ОЦК- решетками
 2015-06-26
2015-06-26 1297
1297








