I. Специфичность. Каждый фермент катализирует превращение одного определённого субстрата либо близких по структуре субстратов. Различают абсолютную и относительную специфичность.
Абсолютная специфичность проявляется тогда, когда фермент действует лишь на одно-единственное вещество и катализирует лишь определённое превращение данного вещества.
Например, фермент уреаза катализирует расщепление мочевины; сахараза – катализирует превращение только сахарозы.
Относительная (групповая) специфичность наблюдается, когда фермент катализирует реакции одного типа с более чем одним структуроподобным субстратом.
Например, пепсин расщепляет белки животного происхождения, хотя они могут различаться друг от друга как по химическому строению, так и по свойствам. Однако он не расщепляет углеводы, так как местом действия пепсина является пептидная связь.
Действие этих ферментов распространяется на большое число субстратов, что позволяет организму обойтись небольшим числом пищеварительных ферментов – иначе их потребовалось бы намного больше.
II. Термолабильность. Повышение температуры на один градус увеличивает скорость ферментативной реакции на 10%. Максимальная активность ферментов при температуре 40 – 50 градусов. Но если резко повышается температура, активность ферментов падает из-за денатурации белка. Низкая температура также снижает активность ферментативного катализа.
III. Активность ферментов зависит от pH среды. Каждый фермент имеет свой оптимум pH среды. Большинство ферментов активны при pH=7,0, но пепсин проявляет свою активность при pH=1,5-2,5, кислая фосфатаза – pH=3,4-6,2.
IV. Обратимость ферментативных реакций, т.е. ферменты, катализируют как реакции синтеза, так и реакции распада.
V. Активность ферментативного катализа зависит от концентрации субстрата. С увеличением концентрации субстрата активность фермента резко возрастает, но до определённого момента. Оптимальная концентрация субстрата – это такое его количество, при котором ферменты проявляют максимальную активность.
VI. Зависимость ферментативных реакций от ингибиторов и активаторов.
Ингибиторы – это вещества, которые тормозят ферментативную реакцию. Есть обратимые и необратимые ингибиторы. Необратимые (денатураторы)- соли тяжёлых металлов, сильные кислоты, Щелочи, фосфорорганические яды.
Ингибирование является необратимым, если ингибитор необратимо связывается с ферментом (образованный комплекс субстрат – ингибитор не распадается). Многие ингибиторы необратимо связываются с ферментами, изменяя их структуру. Этим объясняется токсичное действие ионов металлов: Hg 2+, Zn 2+, Ag+
 E – SH + Ag + E – S – Ag + H+;
E – SH + Ag + E – S – Ag + H+;
В противном случае наблюдается обратимое ингибирование. Обратимое ингибирование может быть конкурентное и неконкурентное.
КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
Конкурентное ингибирование наблюдается, когда ингибитор и субстрат имеют сходные структуры и конкурируют за связывание с активным центром фермента. Если к ферменту Е добавить конкурентный ингибитор I и субстрат S, то одновременно образуются два комплекса: фермент- ингибитор (EI) и фермент-субстратный (ES). Образование комплекса EI не приводит к образованию продукта реакции.
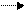
 E+S ES P+ E
E+S ES P+ E
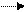
 E+I EI не образуются продукты реакции.
E+I EI не образуются продукты реакции.
Поскольку конкурентный ингибитор связывается обратимо с ферментом, то уменьшить его действие можно, увеличивая концентрацию субстрата, так как при этом увеличивается вероятность связывания фермента с субстратом.
НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
Наблюдается, когда ингибитор и фермент не сходны по структуре и ингибитор присоединяется к регуляторному центру фермента. При этом образуется тройной комплекс: фермент- ингибитор – субстрат, который не приводит к образованию продукта реакции. В данном типе ингибирования влияние ингибитора не может быть преодолено повышением концентрации субстрата.
Активаторы – вещества повышающие активность и скорость ферментативных реакций. К активаторам относятся Ca2+, Mg 2+, Mn 2+, K+, Na+, анионы Сl- и сами ферменты (аутокатализ).
VII. Ферменты обладают высокой каталитической активностью. Например, холинэстераза за 1 секунду расщепляет 300000 молекул ацетилхолина.
 2015-06-26
2015-06-26 503
503








