Специфичность действия ферментов по отношению к субстрату обусловлена их строением и биологической особенностью – лигандностью. Различают следующие виды специфичности энзимов:

Стереохимическая специфичность проявляется в тех условиях, когда энзим катализирует превращение только одного из возможных стереоизомеров субстрата. Например, фумаратгидратаза реагирует с транс-изомером фумаровой кислотой, но не взаимодействует с её цис-изомером малеиновой кислотой:

Имея абсолютную субстратную специфичность, биокатализатор работает лишь с одним веществом. Наблюдающееся явление и пытался объяснить Э.Фишер, который считал, что конформация активного центра жёстко запрограммирована, - поэтому фермент узнаёт только один свой субстрат. Аргиназа разрушает связи только в аргинине.

Уреаза гидролизует только мочевину:
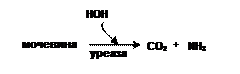
Относительная (групповая) специфичность свидетельствует о том, что фермент может повреждать связи в различных субстратах. Имея первый вариант специфичности, энзим способен производить одну реакцию, но с субстратами, есколько отличающимися по химическому строению. Цитохром Р450 может гидроксилировать (присоединение группы -ОН) около 7000 соединений как природных, так и ксенобиотиков. Большинство протеаз, осуществляющих гидролиз белков, как животного, так и растительного происхождения, находит и расщепляет пептидные связи. Панкреатическая липаза разрушает молекулу любого жира.
Но как понять факт относительной специфичности? Кошланд как раз и предложил свою теорию «индуцированного контакта». По его мнению, как отмечено выше, пространственная укладка активного центра свободного энзима только намечена, а по мере приближения к нему субстрата группировки последнего несколько меняют расположение участков контактной площадки, приспосабливая её для будущей своей работы. Отсюда различные, но сходные по строению вещества способны преобразовываться одним и тем же ферментом.
 2015-06-26
2015-06-26 858
858








