Наличие отека легких необходимо подтвердить рентгенологически [1]. Для неинвазивного определения насыщения артериальной крови кислородом рекомендуют использовать пульсовую оксиметрию. Как и при кардиогенном шоке, важнейшую роль в уточнении патогенеза развившегося осложнения играет двухмерная ЭхоКГ с цветным допплеровским исследованием.
Цель лечения кардиогенного отека легких – уменьшить давление в капиллярах легких. Основную роль отводят вазодилататорам с возможным добавлением мочегонного [1]. Подчеркивают, что сочетание высокой дозы вазодилататорас умеренными дозами мочегонных предпочтительнее, поскольку не приводит к гиповолемии, снижению сердечного выброса ивоздействует на основной патогенетический механизм осложнения – острое перераспределение крови. Так, в небольшом контролируемом исследовании G. Cotter с соавт. частое болюсное введение достаточно высоких доз изосорбида динитрата в сочетании с умеренной дозой фуросемида лучше переносилось и позволяло эффективнее уменьшить симптомы кардиогенного отека легких по сравнению с сочетанием высокой дозы мочегонного с небольшой дозой нитрата [38]. Вместе с тем достаточно высокие дозы мочегонных у больных с длительно существующей СН и симптомами задержки жидкости – обязательное условие для компенсации.
У больных с гипертензивной острой СН рекомендуют достаточно быстрое снижение АД – на 30 мм рт. ст. за несколько минут с последующим более медленным снижением до цифр, отмеченных до гипертензивного криза (за несколько часов). Предлагают использовать внутривенное введение петлевых диуретиков (особенно у больных ХСН с задержкой жидкости), внутривенную инфузию нитроглицерина или нитропруссида натрия.
Для устранения удушья препаратом выбора считают морфин, при выраженной бронхообструкции могут понадобиться бронходилататоры [1].
Важнейшую роль в лечении отека легких играет дыхательная поддержка. При этом во многих случаях для устранения гипоксемии может потребоваться неинвазивная вспомогательная вентиляция легких через маску с сохранением спонтанного дыхания больного, а при недостаточной эффективности этих мероприятий, тяжелой гипоксемии, выраженной гиперкапнии речь обычно идет об интубации трахеи с ИВЛ. Есть сообщения, что неинвазивная вспомогательная вентиляция легких эффективнее стандартного дыхания 100%-м кислородом через маску. Так, при мета-анализе 23 рандомизированных исследовании по сопоставлению этих двух подходов оказалось, что режим с поддержанием постоянного положительного давления в дыхательных путях позволяет достоверно уменьшить риск смерти в стационаре на 41 % и риск утяжеления дыхательной недостаточности с необходимостью интубации трахеи и ИВЛ на 54% [39]. Однако небольшое количество изученных больных не позволяло считать этот результат окончательным. Недавно представленное достаточно крупное рандомизированное исследование ЗСРО (1156 больных) принесло разочарование – различные режимынеинвазивной вспомогательной вентиляции легких в сравнении с обычной оксигенотерапией не имели преимущества по влиянию на смертность, хотя и способствовали несколько большему уменьшению тахикардии, частоты дыхания и выраженности ацидоза в первый час после начала лечения [40].
Очевидно также, что необходимо срочно устранить тахи- или брадиаритмии, которые могут лежать в основе отека легких. Для этой цели предпочтительны электрическая кардиоверсия или электрокардиостимуляция [1].
|
| Вмешательства I ряда |





|
|
|
|
|
|
 Вмешательства II ряда Вмешательства II ряда
|
 Вмешательства III ряда Вмешательства III ряда
|
 | |||||
 | |||||
|
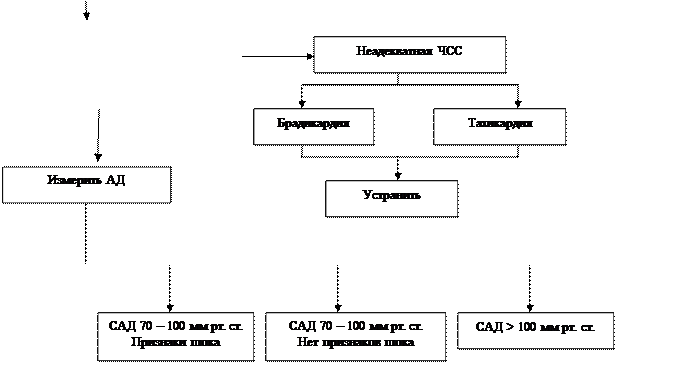
Рисунок 2. Неотложное лечение больных инфарктом миокарда с отеком легких [15, с изменениями]
Инотропную поддержку (добутамин) обсуждают при наличии артериальной гипотензии, а также в случаях, когда первоначальное лечение вазодилататорами и мочегонными оказалось недостаточно эффективными. При этом очевидно, что кардиотонические препараты показаны только в случаях, когда в основе отека легких лежит существенное снижение сократительной способности миокарда ЛЖ.
Ряд лет большие надежды возлагали на кардиотонический препарат со свойствами вазодилататора левосимендана [41]. Результаты небольшого рандомизированного двойного слепого клинического испытания LIDO (203 человека) указывали на более выраженные положительные изменения показателей гемодинамики на фоне введения левосимендана в сравнении с добутамином и возможное преимущество левосимендана по влиянию на смертность больных с острой декомпенсацией ХСН, связанной с сократительной дисфункцией ЛЖ [42]. Отмечалось также положительное влияние на симптомы и смертность при введении препарата больным с недавно перенесенным ИМ и застоем в легких в плацебо-контролируемом исследовании второй фазы [43]. Однако результаты последующих более крупных клинических испытаний принесли разочарование. Так, в рандомизированном исследовании SURVIVE (1327 больных) единственным существенным преимуществом краткосрочной инфузии левосимендана перед добутамином у больных с острой декомпенсацией СН явилось более выраженное снижение уровня мозгового натрийуретического пептида в ранние сроки заболевания [44]. Вместе с тем остается надежда, что при более дифференцированном подходе к использованию этого лекарственного средства с учетом особенностей его гемодинамического действия клинический эффект может оказаться более выраженным. В качестве целевой группы можно думать о больных с острой декомпенсацией ХСН, получающих β-адреноблокаторы, со сниженной ФВ и высоким ДЗЛА. Кроме того, очевидно, до начала введения левосимендана необходимо устранить гиповолемию и избегать чрезмерно высоких начальных доз, способных вызвать артериальную гипотензию.
Катетеризацию легочной артерии для определения параметров центральной гемодинамики у больных с острой СН считают целесообразной только в случаях, когда нет ожидаемого ответа на стандартное лечение, а также когда имеется сочетание застоя в легких с признаками периферической гипоперфузии [1].
У больных ИМ эксперты ЕКО рекомендуют оксигенотерапию и внутривенное введение петлевого диуретика (фуросемид в дозе 20-40мг) [2]. В случаях, когда самостоятельное дыхание 100%-м кислородом, подаваемым со скоростью 8-10л/мин через маску, не позволяет достичь напряжения кислорода в артериальной крови более 60мм рт. ст., рекомендуется интубация трахеи и ИВЛ. При отсутствии артериальной гипотензии показана внутривенная инфузия нитроглицерина, доза которого подбирается таким образом, чтобы обеспечить снижение АД на 15 мм рт. ст. (при этом САД не должно быть ниже 90 мм рт. ст.). Предлагается также рассмотреть возможность установки плавающего катетера в легочную артерию, чтобы обеспечить поддержание ДЗЛА ниже 20мм рт. ст. и СИ выше 2л/мин. У больных с артериальной гипотензией рекомендуют использовать домамин в дозе 2,5-5 мкг/кг/мин (если есть признаки сниженной перфузии почек) или добутамин 2,5-10 мкг/кг/мин (если в клинической картине преобладает застой в легких).
Схема ведения больных ИМ с отеком легких, рекомендуемая АКК/ААС, представлена на рисунке 2 [15]. Эксперты подчеркивают необходимость особой осторожности при выборе дозы петлевого диуретика, поскольку введение слишком высокой дозы больному, не имеющему задержки жидкости, способно спровоцировать гиповолемию с выраженным снижением АД. Кроме того, ускоренное внутривенное введение фуросемида в дозах выше 1 мг/кг может спровоцировать вазоконстрикцию. В случаях, когда быстрого улучшения на фоне лечения не происходит или проводится введение вазопрессорных или кардиотонических препаратов, предлагают установить плавающий катетер в легочную артерию. При внутривенном введении больших доз мощных вазодилататоров обсуждается целесообразность определения АД через артериальный катетер.
Также как и кардиогенный шок, отек легких у больных с острой ишемией миокарда – показание к неотложной коронарной ангиографии и реваскуляризации миокарда [4, 15,25-27].
Таким образом, лечение крайних проявлений острой СН – отека легких и особенно кардиогенного шока – сложнейшая задача, требующая согласованных усилий врачей различных специальностей и предъявляющая высокие требования к организации медицинской помощи в целом. У значительной части больных при своевременном и надлежащем лечении эти состояния обратимы, однако чтобы добиться положительного результата быстрое начало медикаментозной терапии должно сочетаться с высокотехнологичными методами диагностики и лечения. При этом в большинстве случаев недопустимы даже небольшие задержки во времени. Среди необходимых условий своевременного и адекватного лечения – быстрое прибытие к больному бригады медицинских работников, владеющих современными алгоритмами оказания неотложной помощи и располагающих необходимыми лекарственными средствами и оборудованием (включая фибринолитик, возможность дыхательной поддержки, кардиоверсии и электрокардиостимуляции). Не менее важна скорейшая транспортировка больных в стационар, обладающий возможностями углубленного обследования кардиологических больных, а также круглосуточного рентгеноэндоваскулярного и кардиохирургического лечения. Очевидно также, что есть потребность в наличии службы, способной осуществлять транспортировку больных с кардиогенным шоком или рефрактерным отеком легких из стационаров, не располагающих необходимыми возможностями, в крупные лечебные центры, используя средства механической поддержки кровообращения (внутриаортальная баллонная контрпульсация) и дыхания (искусственная вентиляция легких).
СПИСОК ЛИТЕРАТУРЫ
1. Nieminen MS, Bohm M, CowieMRei al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J.2005; 26 (4)384-416.
2. Management of Acute Myocardial Infarction in patients presenting with ST-segment elevation. The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Eur Heart J. 2003;24 (1):28-66.
3. Nieminen MS, Brutsaert D, Dkkstein К et al. EuroHeart Failure Survey II (EHFS II): a survey on hospitalized acme heart failure patients: description ofpopulation. Eur Heart J. 2006;27 (22);2725-2736.
4. Killip T III, Kimball JT. Treatment of myocardial infarction in a coronary care unit: a two year experience with 250 patients/ Am JCardiol. 1967;20 (4):457-64.
5. Goldberg RJ, Gore JM, Alpert JS et al. Cardiogenic shock after acute myocardial infarction. Incidence and mortality from a community-wide perspective, 1975 to 1988.N Engl J Med. 1991;325 (16): 1117-1122.
6. Holmes OR Jr., Bates ER Kleiman N. S, et al. Contemporary reperfusion therapy for cardiogenic shock: the GUSTO-I trial experience. J Am Coll Cardiol. 1995;26 (3): 668-674.
7.MenonV, Hochman JS, Stebbins A et al. Lack of progress in cardiogenic shock: lessons from the GUSTO trials. Eur Heart J. 2000;21 (23): 1928-1936.
8. Явелов И. С, Грацианский Н. А. Российский регистр острых коронарных синдромов: лечение и исходы в стационаре при остром коронарном синдроме без подъемов сегментов ST. Кардиология. 2003;43 (12): 23-36.
9. Явелов И. С, Грацианский Н. А. Российский регистр острых коронарных синдромов: лечение и исходы в стационаре при остром коронарном синдроме с подъемами сегмента ST. Кардиология 2004;44 (4): 4-13.
10. Hochman JS, Buller CE, Sleeper LA et al. Cardiogenic shock complicating acute myocardial infarction-etiologies, management and outcome: a report from the SHOCK Trial Registry. Should we emergently revascularize Occluded Coronaries for cardiogenic shocK? J Am Coll Cardiol. 2000;36 (3 Suppl A); 1063-1070.
11. Webb JG, Sleeper LA, Buller CE et al. Implications of the timing of onset of cardiogenic shock after acute myocardial infarction: a report from the SHOCK Trial Registry. SHould we emergenlly revascularize Occluded Coronaries for cardiogenic shocK? J Am Coll Cardiol. 2000;36 (3 Suppl A): 1084-1090.
12. Jacobs AK, French JK, Col J et al. Cardiogenic Shock With Non-ST-Segment Elevation Myocardial Infarction: A Repoft from the SHOCK Trial Registry. J Am Coll Cardiol. 2000;36 (3 Suppl A): 1091-1016.
13. Jacobs AK, Leopold JA, Bates E et al. Cardiogenic Shock Caused by Right Ventricular Infarction. A Report From the SHOCK Registry. J Am Coll Cardiol. 2003;41 (8): 1273-1279.
14. Menon V, Webb JG, Hillis LD et al. Outcome and Profile of Ventricular Septal Rupture With Cardiogenic Shock After Myocardiai Infarction: A Report from the SHOCK Trial Registry, J Am Coll Cardiol. 2000;36 (3 Suppl A): l 110-1116.
15. ACC/AHA Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction. A Report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction). Полная версия доступна на сайте www.acc.org.
16. Dalen J. E. The pulmonary artery catheter – friend, foe, or accomplice? JAMA. 2001;286 (3): 348-350.
17. Rhodes A, Cusack RJ, Newman PJ et al. A randomized, controlled trial of the pulmonary artery catheter in critically ill patients. Intensive Care Med. 2002:28 (3): 256-264.
18. Shah MR, Hasselblad V, Stevenson LW et al. Impact of the Pulmonary Artery Catheter in Critically III Patients. Meta-analysis of Randomized Clinical Trials. JAMA. 2005;294 (13): 1664-1670.
19. Chen ZM, Pan HC, Chen YP et al. Early intravenous then oral metoprolol in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet. 2005;366 (9497): 1622-1632.
20. Hochman JS, Sleeper LA, Webb JG et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. N Engl J Med. 1999;341 (9): 625-634.
21. Hochman JS, Sleeper LA, White HDetal. SHOCK Investigators. One-year survival following early revasculariation for cardiogenic shock. JAMA. 2001:285 (2): 190-192. 22. Hochman JS, Sleeper LA, Webb JG el al. Early Revascularizalion and Long-term Survival in Cardiogenic Shock Complicating Acute Myocardial Infarction. JAMA. 2006;295 (21): 2511-2515.
23. Dzavik V, Sleeper LA, Cocke TP. Early revascularization is associated with improved survival in elderly patients with acute myocardial infarction complicated by cardiogenic shock: a report from the SHOCK Trial Registry. Јur Heart J. 2003;24 (9): 828-837.
24. Sanborn ТА, Sleeper IA, Bates ER et al. Impact of Thrombolysis, Intra-aortic Balloon Pump Counterpulsation, and The Combination in Cardiogenic Shock Complicating Acute Myocardial Infarction: A Report from the SHOCK Trial Registry. J Am Coll Cardiol. 2000;36 (3 Suppl A): 1123-1129.
25. King SB 3rd, Smith SC Jr, Hirshfeld JW Jr et al. 2007 Focused Update of the ACC/AHA/SCAI 2005 Guideline Update for Percutaneous Coronary Intervention: A Report of the American College Cardiology/Amencan Heart Association Task Force on Practice Guidelines. J Am Coif Cardiol. 2008,51 (2): 172-209. 26. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. The Task Force for the Diagnosis and Treatment of Non-ST-Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology. Eur Heart J.2007;28 (13): 1598-1660.
27. ACC/AHA 2007 Guidelines for the Management of Patients With Unstable Angina/Non – ST-Elevation Myocardial Infarction. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/Non – ST-Elevation Infarction). J Am Coll Cardiol. 2007;50 (1): 1-157.
28. Zeymer U, Neuhaus KL, Wegscheider К et al. Effects of thrombolytic therapy in acute inferior myocardial infarction with or without right ventricular involvement. HIT-4 Trial Group. Hirudin for Improvement of Thrombolysis. J Am Coll Cardiol. 1998;32 (4); 876-881.
29. Moreyra AE, Suh С, Porway MN, Kostis JB. Rapid hemodynamic improvement in right ventricular infarction after coronary angioplasty. Chest. 1988;94 (1): 197-199. 30. Bowers TR, O'Neill WW, Ghnes C et al. Effect of reperfusion on biventricular function and survival after right ventricular infarction. N Engl J Med 1998;338 (14): 933-940.
31. Slater J, Brown RJ, Antonelli ТА et al. Cardiogenic Shock Due to Cardiac Free-wall Rupture or Tamponade After Acute Myocardial Infarction: A Report from the SHOCK Trial Registry. J Am Coll Cardiol. 2000;36 (3 Suppl А): 1117-1112.
32. Topaz 0, Taylor AL. Interventricular septal rupture complicating acute myocardial infarction: from pathophysiologic features to the role of invasive and noninvasive diagnostic modalities in current management. Am J Med. 1992;93 (6): 683-688.
33. Piwnica A. Update in surgical treatment of acute post infarction VSDs and Mis. Eur J Cardiolhorac Surg. 1995;9 (3): 117-119.
34. Crenshaw BS, Granger C8, Birnbaum Y el al, for the GUSTO-I (Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries) Trial Investigators. Risk factors, angiographic patterns, and outcomes in patients with ventricular septal defect complicating acute myocardial infarction. Circulation. 2000;101 (l): 27-32.
35. Thompson CR, Buller CE, Sleeper LA et al. Cardiogenic Shock Due to Acute Severe Mitral Regulation Complicating Acute Myocardial Infarction: A Report from the SHOCK Trial Registry. J Am Coll Cardiol. 2000;36 (3 Suppl A): 1104-1109.
36. Gahdni SK, Powers JC, Nomier A-M et al. The Pathogenesis of Acute Pulmonary Edema Associated With Hypertension. N Engl J Med 2001;334 (l): 17-22.
37. Bhatia RS, Tu JV, Lee DS et al. Outcome of Heart Failure with Preserved Ejection Fraction in a Population-Based Study. N Engl J Med. 2006;355 (3): 260-269.
38. Cotter G, Metzkor E, Kaluski E et al. Randomised trial of high-dose isosorbide dinitrate plus low-dose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. Lancet. 1998;351 (9100): 389-393.
39. Peter JV, Moran JL, Phillips-Hughes t et al. Effect of non-invasive positive pressure ventilation (NIPPV) on mortality in patients with acute cardiogenic pulmonary oedema: a meta-analysis. Lancet. 2006;367 (9517): 1155-1163.
40. Symptom benefits, but no life savings with noninvasive ventilation for acute cardiogenic pulmonary edema. Подготовлено Wood S. Доступно на http://www.theHeart.org.
41. Явелов И.С. Клиническая эффективность сенситизатора кальция – представителя нового класса препаратов с положительным инотропным дейавием при сердечной недостаточности и инфаркте миокарда. Журнал Сердечная недостаточность. 20015;6 (1): 33-45.
42. Follath F, Cleland JG, Just H et al. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomised double-blind trial. Lancet. 2002:360 (9328): 196-202.
43. Moiseyev VS, Poder P, Andrejevs N et al. Safety and efficacy of a novel calcium sensitizer, levosimendan, m patients with left ventricular failure due to an acute myocardial infarction. A randomized, placebo-controlled, double-blind study (RUSSLAN). Eur Heart J 2002;23 (18): 1422-1432.
44. Mebazaa A, Nieminen MS, Packer M et at. Levosimendan vs Dobutamine for Patients With Acute Decompensated Heart Failure. The SURVIVE Randomized Trial. JAMA. 2007;297 (17): 1883-1891.
 2015-07-04
2015-07-04 443
443








