В природе все процессы характеризуются определенной направленностью, они совершаются сами собой только в одном направлении и достигают конечных состояний, которые называются равновесными, например, процесс взаимной диффузии двух газов или образование раствора, взрыв. Но обратно вернуться в исходное состояние после окончания процесса система сама не может, для этого необходимо приложить энергию из вне. Эти процессы называют необратимыми.
Процессы, в которых после завершения цикла и система, и окружающая среда возвращаются в исходное состояние, называются обратимыми (равновесными).
Процессы, в котором изучаемая система после ряда возможных изменений возвращается в свое исходное состояние, называют циклическим (цикл).
Второй закон термодинамики формулируется так:
Если система совершает круговой цикл в виде ряда (n) последовательных процессов и в каждом из них обменивается с окружающей средой теплотой (Qi), то сумма приведенных теплот (Qi/Ti) по всем процессам цикла равна нулю для обратимого процесса и отрицательна для необратимого.
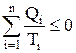 (19)
(19)
В практическом применении уравнения (19) суммирование заменяют интегрированием. При этом интегрирование проводится по замкнутому пути (контуру), включающему все процессы, составляющие цикл.
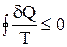
 (20)
(20)
 2015-07-03
2015-07-03 1047
1047








