(следствия закона Гесса)
Согласно закону Гесса тепловой эффект химического процесса не зависит от того какими путями, через какие промежуточные стадии получены продукты, а зависит лишь от начального и конечного состояний химических превращений.
Стандартный тепловой эффект ΔН 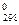 реакции при 298 К
реакции при 298 К
Пример. Вычислить ΔН 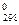 реакции 2CaF2 г + SiO2 т = 2 СаОт + SiF4 г при температуре 298 К.
реакции 2CaF2 г + SiO2 т = 2 СаОт + SiF4 г при температуре 298 К.
Решение:
Согласно следствию из закона Гесса тепловой эффект химической реакции равен разности суммы произведений теплот образования продуктов реакции на соответствующие стехиометрические коэффициенты и суммы произведений теплот образований исходных веществ на соответствующие стехиометрические коэффициенты.
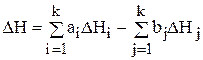 , (18)
, (18)
где ΔНi – энтальпии образования продуктов реакции;
аi – стехиометрические коэффициенты продуктов реакции;
ΔНj– энтальпии образования исходных веществ;
bj - стехиометрические коэффициенты исходных веществ.
1)Для определения теплового эффекта приведенной выше реакции при температуре 298 К используем следующее уравнение
ΔН 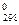 (химической реакции) = аi ΔН
(химической реакции) = аi ΔН 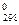 i – bj ΔН
i – bj ΔН 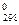 j.
j.
Находим составляющие этого уравнения. Сначала по справочнику [3] для всех веществ, участвующих в реакции, определяем стандартные энтальпии образования ΔН 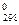 , кДж/моль:
, кДж/моль:
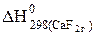 = -1214;
= -1214; 
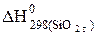 = - 859;
= - 859;
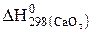 = - 635;
= - 635; 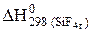 = -1548.
= -1548.
2) Далее вычисляем сумму произведений величин ΔН 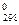 продуктов реакции на соответствующие значения стехиометрических коэффициентов:
продуктов реакции на соответствующие значения стехиометрических коэффициентов:
2 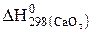 +
+ 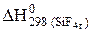 = 2×(-635) + 1×(-1548) = -2818 кДж.
= 2×(-635) + 1×(-1548) = -2818 кДж.
3) Аналогичный расчет проводим для исходных веществ:
ΔН 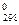 (исходных веществ) = -3287 кДж.
(исходных веществ) = -3287 кДж.
4) Рассчитываем стандартный тепловой эффект химической реакции при Т = 298 К:
ΔН 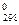 = (-2818) - (-3287) = 469кДж.
= (-2818) - (-3287) = 469кДж.
 2015-07-03
2015-07-03 5403
5403
