1. Положение металла в ряду активности металлов: чем дальше они расположены друг от друга тем быстрее происходит коррозия.
2. Чистота металла: примеси ускоряют коррозию.
3. Неровности поверхности металла, трещины
4. Грунтовые воды, морская вода, среда электролита.
5. Повышение температуры.
6. Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Термодинамика электрохимической коррозии
Стремлением металлов переходить из металлического состояния в ионное для различных металлов различно. Вероятность такого перехода зависит также от природы коррозионной среды. Такую вероятность можно выразить уменьшением свободной энергии при протекании реакции перехода в заданной среде при определенных условиях. Но прямой связи между термодинамическим рядом и коррозией металлов нет. Это объясняется тем, что термодинамические данные получены для идеально чистой поверхности металла, в то время как в реальных условиях корродирующий металл покрыт слоем (пленкой) продуктов взаимодействия металла со средой. Для расчетов изменения свободной энергии реакции при электрохимической коррозии металла используют величины электродных потенциалов. Следовательно, для электрохимического растворения металла необходимо присутствие в растворе окислителя (деполяризатора, который бы осуществлял катодную реакцию ассимиляции электронов), обратимый окислительно - восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях.
Катодные процессы при электрохимической коррозии могут осуществляться различными веществами.
1. ионами
2. молекулами
3. оксидами и гидрооксидами (как правило малорастворимыми продуктами коррозии, образованными на поверхности металлов)
4. 4. органическими соединениями где R радикал или молекула
В коррозионной практике в качестве окислителей-деполяризаторов, осуществляющих коррозию, выступают ионы водорода и молекулы растворенного в электролите кислорода. При увеличении активности ионов металла (повышение концентрации ионов металла в растворе), потенциал анода возрастает, что приводит к торможению растворения металла. Понижение активности металла, напротив, способствует растворению металла.
Потенциал и ток коррозии. Поляризация в электрохимических процессах. Скорость процесса в соответствии с законом Фарадея. Экспериментальное определение скорости коррозии. Основные случаи возникновения коррозионных гальванических пар.
I = ( jок - jоа ) / R
I - ток гальванического элемента
jок , jоа - электрохимические потенциалы соответственно катода и анода, определенные при условии холостого хода гальванического элемента ( при I = 0 )
R - сопротивление цепи анод-среда-катод
I = A e h / B
h - смещение потенциала относительно своего равновесного состояния и обычно называемое перенапряжением процесса
A, B - некоторые константы, зависящие от параметров окружающей
среды и свойств металла
R пол = h / I
R пол - сопротивление двойного электрического слоя металл-электролит
Э.Д.С. элемента тратится на преодоление омического сопротивления коррозионной среды в цепи между анодом и катодом и двух поляризационных сопротивлений
jок -jоа = hк + hа + DU с
I = (hк + hа + D U с ) / (P к / S к + P а / S a + R с )
hк, hа - величина напряжения на поляризационном сопротивлении катода и анода соответственно
D U с - падение напряжения в коррозионной среде
P к , P а - удельные поляризационные сопротивления катода и анода, Ом.м2
S к, S a - площади катода и анода, м2
R c - сопротивление среды между электродами, Ом
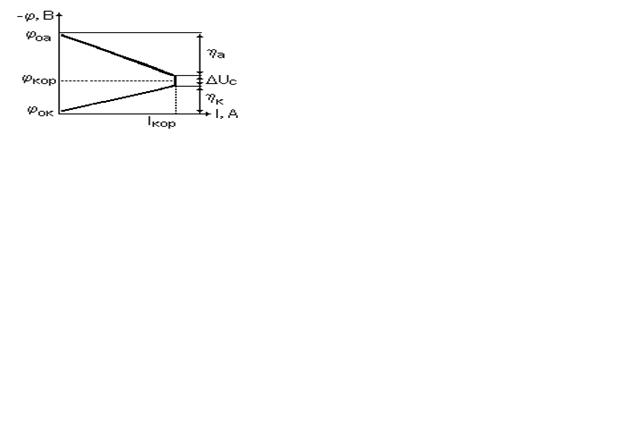
Е = jок - jоа - э.д.с. коррозионной гальванопары
hа, hк, D U c - напряжения участков цепи соответственно на поляризационном сопротивлении анода, катода и в среде между ними
Ø Чем больше ток поляризации (I), тем сильнее поляризуются - изменяют свой потенциал - электроды. При этом анод поляризуется положительно (hа > 0), т.е. его потенциал становится более положительным, а катод - отрицательно, так как hк < 0.
Ø В конечном счете электроды пары приобретают некоторый средний потенциал jкор, называемый потенциалом коррозии. Этот потенциал в точности определялся бы точкой пересечения анодной и катодной характеристик, если бы можно было пренебречь омической составляющей цепи - падением напряжения в среде (DU с ).
Ø Ток коррозии I кор зависит от разности электродных потенциалов (joa, jок), которые, к сожалению, далеко не всегда известны, а не от потенциала коррозии jкор. Несмотря на свое имя, потенциал коррозии не определяет ток коррозии, а скорее наоборот: при токе коррозии I кор устанавливается некий компромисный потенциал jкор.
Ø Ток коррозии тем выше, чем меньше поляризационное сопротивление. Очевидно, что ток коррозии тем выше, чем меньше сопротивление среды.
¨ ПОЛЯРИЗАЦИЯ В ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССАХ
Равновесные потенциалы электродов могут быть
определены в условиях отсутствия в цепи тока. При
прохождении электрического тока потенциалы
электродов меняются. Это явление называют
поляризацией:
∆φ = φi - φр,
∆φ - поляризация
φi - потенциал электрода при прохождении тока
φр - равновесный потенциал (i = 0)
Любая электрохимическая реакция многостадийна.
1) подвод реагентов к электроду
2) собственно электрохимическая реакция
3) отвод продуктов реакции от электрода
возникновение поляризации обусловлено замедленностью отдельных стадий электрохимического процесса
Изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока называется концентрационной поляризацией.
Изменение потенциала, обусловленное замедленностью собственно электрохимических стадий реакций, называется электрохимической поляризацией (перенапряжением).
Закон Фарадея: количество электричества, стекающего с электрода, пропорционально потере массы этого электрода
G = qIТ
q= 3600, M / (nF)
G - масса растворившегося металла, г
q - электрохимический эквивалент металла, гA-1.ч-1
M - атомная масса, г/моль
F = 96500 - число Фарадея, Кл/г.Экв
n - валентность металла; I - величина электродного тока, А
T - время, ч
плотность тока коррозии
j = I / S = G / (SqT)
практические формулы для расчета скорости коррозии
ì 0,95 v 1
j = í
î 0,85 v 2,
j – плотность анодного тока коррозии, А/м2
v 1 - скорость весовой коррозии, г/(м2ч)
v 2 - скорость проникающей коррозии, мм/год
величина плотности анодного тока есть мера скорости коррозии
ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ СКОРОСТИ КОРРОЗИИ
По величине поляризационного сопротивления
Коррозиметры общего применения контролируют величину поляризационного сопротивления двух электродов датчика, погружаемых в коррозионную среду и подключаемых к внешнему источнику постоянного тока малого напряжения (U» 10 мВ). При этом измеряют наложенный ток пары (I), определяют поляризационное сопротивление
R пол = U / I и, вводя некоторый поправочный коэффициент, находят скорость коррозии.
Недостатки:
1. при измерениях фиксируют воздействие коррозионной среды на электроды датчика, но не на самое металлическое сооружение, ради которого проводятся измерения.
2. Метод не позволяет регистрировать какие-либо коррозионные гальванопары
Гравиметрия
Измеряют общую коррозию образца-свидетеля,
который помещают в коррозионную среду, по
возможности моделируя реальные условия
эксплуатации сооружения.
Недостатки:
1. Метод широко применяется для лабораторных исследований, но мало пригоден для полевых.
2. Длительность.
Контроль электросопротивления
Измерительными датчиками в данном случае являются
проволочные или иные элементы,сопротивление которых
увеличивается в процессе их коррозионного разрушения (за
счет уменьшения поперечного сечения). Коррозиметры,
построенные на этом принципе, - весьма точные электрические
измерительные приборы, позволяющие наблюдать коррозию
во времени.
Недостатки:
1. как и прочие методы измерения, регистрируют лишь коррозию датчиков, а не реального металлического сооружения.
Ультразвуковой контроль позволяет определять фактическую толщину стенки трубопровода или резервуара по изменению времени прохождения ультразвукового сигнала через стенку.
Радиографический контроль осуществляют с помощью рентгеновских лучей, “просвечивая” стенку резервуара или аппарата.
¨ ОСНОВНЫЕ СЛУЧАИ ВОЗНИКНОВЕНИЯ КОРРОЗИОННЫХ ГАЛЬВАНИЧЕСКИХ ПАР
Коррозия при контакте двух металлов
(-) Fe | водный раствор электролита | Cu (+)
(-) A (Fe): Е°Fe/Fe2+ = -0,44 В
ЕH2/2H+(рН = 10) = -0,59 В
(+) K (Cu): ЕOH-/O2 (рН = 10) = +0,64 В
возможна коррозия железа только с кислородной деполяризацией, так как
ЕH2/2H+ < Е°Fe/Fe2+
2Fe + O2 + 2H2O = 2Fe(OH)2
Образующийся гидроксид железа (II) подвергается последующему окислению:
4Fe(OH)2 + O2 + H2O = 4Fe(OH)3
При этом образуется ржавчина (xFe2O3· yH2O).
 2015-07-04
2015-07-04 5176
5176
