 Діазинами називають шестичленні гетероцикли, що містять як гетероатоми два атоми азоту. Існує три ізомерні діазинй піридазин (1,2-діазин), піримідин (1,3-діазин) і піразин (1,4-діазин). За будовою та властивостями ці сполуки багато в чому нагадують піридин. Подібно піридину, молекули піридазину, піримідину та піразину мають у своєму складі замкнену спряжену систему з шести π-електронів та мають ароматичний характер. Неподілені пари електронів атомів азоту не беруть участі у спряженні та надають діазинам основних властивостей. Через дезактивуючий вплив атомів азоту один на одного піридазин, піримідин і піразин є слабшими основами, ніж піридин (рКВН+ піридазину у воді 2,33; піримідину 1,3; піразину 0,6; піридину 5,25). Тому діазинй, незважаючи на наявність двох основних центрів, утворюють солі тільки з одним еквівалентом мінеральної кислоти.
Діазинами називають шестичленні гетероцикли, що містять як гетероатоми два атоми азоту. Існує три ізомерні діазинй піридазин (1,2-діазин), піримідин (1,3-діазин) і піразин (1,4-діазин). За будовою та властивостями ці сполуки багато в чому нагадують піридин. Подібно піридину, молекули піридазину, піримідину та піразину мають у своєму складі замкнену спряжену систему з шести π-електронів та мають ароматичний характер. Неподілені пари електронів атомів азоту не беруть участі у спряженні та надають діазинам основних властивостей. Через дезактивуючий вплив атомів азоту один на одного піридазин, піримідин і піразин є слабшими основами, ніж піридин (рКВН+ піридазину у воді 2,33; піримідину 1,3; піразину 0,6; піридину 5,25). Тому діазинй, незважаючи на наявність двох основних центрів, утворюють солі тільки з одним еквівалентом мінеральної кислоти.
Наявність в структурі молекул піридазину, піримідину і піразину двох атомів азоту піридинового типу приводить до значного зменшення електронної густини на атомах вуглецю діазинового циклу. Тому діазинй мають дуже малу реакційну здатність в реакціях SE і, навпаки, високу активність в реакціях SN. Реакції електрофільного заміщення можливі тільки тоді, як діазиновий цикл активовано електронодонорними групами, наприклад, -NH2, -OH та ін.
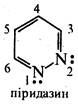
А. Піридазин (1,2-діазин).
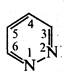 Піридазин — безбарвна рідина (т. кип. 207 °С) зі слабким запахом, розчинна у воді, етанолі, бензолі, діетиловому ефірі, не розчинна в петролейному ефірі. Піридазин і його похідні добувають конденсацією гідразину з насиченими або ненасиченими 1,4-дикарбонільними сполуками.
Піридазин — безбарвна рідина (т. кип. 207 °С) зі слабким запахом, розчинна у воді, етанолі, бензолі, діетиловому ефірі, не розчинна в петролейному ефірі. Піридазин і його похідні добувають конденсацією гідразину з насиченими або ненасиченими 1,4-дикарбонільними сполуками.
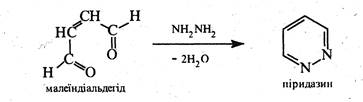
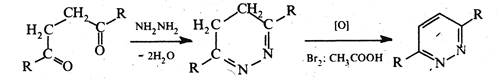
Перевага синтезів з ненасиченими 1,4-дикарбонільними сполуками полягає в тому, що продукт, який утворюється, не потребує дальшого окиснення.
Піридазин є слабкою основою. З кислотами (хлороводневою, пікриновою) і алкілгалогенідами він утворює солі за участю одного атома азоту.
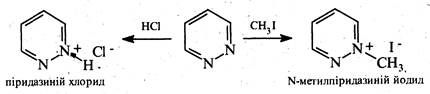
В реакції електрофільного заміщення піридазин вступає насилу. Здійснити реакції нітрування, сульфування, галогенування практично не вдається.
Під дією пероксикислот піридазин окиснюється, утворюючи N-оксид:
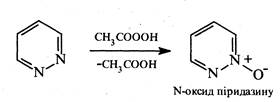
При відновленні піридазину натрієм у спиртовому розчині або каталітичному гідруванні розкривається цикл і утворюється тетраметилендіамін:
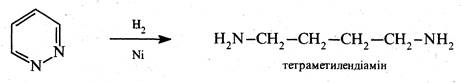
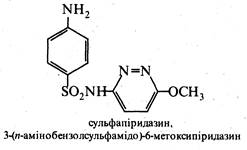
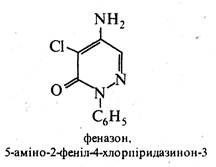
Похідні піридазину застосовують як лікарські препарати та гербіциди. Так, піридазиновий цикл містить молекула лікарського препарату сульфапіридазину, що виявляє антибактеріальну активність, і молекула гербіциду феназону, використовуваного для знищення бур'янів на полях цукрових буряків.
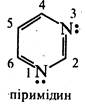
Б. Піримідин (1,3-діазин)
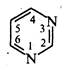 Способи добування. Піримідин і його похідні найчастіше добувають конденсацією сечовини або тіосечовини з 1,3-дикарбонільними сполуками. Так, при взаємодії сечовини з малоновим ефіром у присутності етоксиду натрію утворюється похідне піримідину — барбітурова кислота, котра існує в оксо- та гідроксиформі:
Способи добування. Піримідин і його похідні найчастіше добувають конденсацією сечовини або тіосечовини з 1,3-дикарбонільними сполуками. Так, при взаємодії сечовини з малоновим ефіром у присутності етоксиду натрію утворюється похідне піримідину — барбітурова кислота, котра існує в оксо- та гідроксиформі:
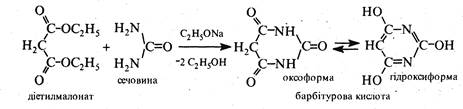
Для добування піримідину барбітурову кислоту дією хлороксиду або пентаоксиду фосфору перетворюють на 2,4,6-трихлорпіримідин (в реакцію вступає гідроксиформа), котрий потім відновлюють:
Фізичні властивості Піримідин - безбарвна кристалічна речовина (т. пл. 22,5 °С), легко розчинна у воді, етанолі, діетиловому ефірі.
Хімічні властивості. За хімічними властивостями піримідин схожий на піридин, але, як і інші діазини, характеризується нижчою реакційною здатністю.
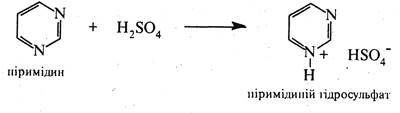
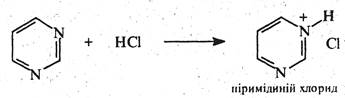
Незважаючи на наявність у молекулі піримідину двох основних центрів, у реакціях з мінеральними кислотами він утворює солі за участю одного атома азоту:
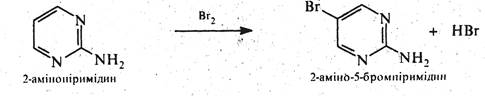
Через електроноакцепторний вплив двох атомів азоту піримідин практично не вступає в реакції електрофільного заміщення. Але якщо піримідиновий цикл активовано одним або декількома електронодонорними замісниками (-NH2, -ОH, -SH та ін.) можливі реакції електрофільного заміщення (нітруваннй, галогенування, сульфування, нітрозування, азосполучення) переважно за положенням 5, наприклад:
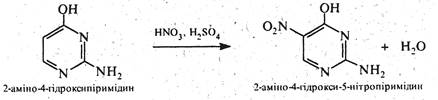
Нуклеофільні реагенти атакують в молекулах піримідину та його похідних електронодефіцитні положення 2, 4 та 6. Так, при дії амідом натрію на 4-метилпіримідин утворюються 2-аміно- та 2,4-діаміно-6-метилпіримідини:
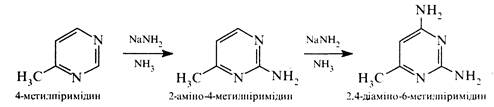
Нуклеофільне заміщення в ряду піримідинів часто супроводжується розкриттям циклу.
Найважливіші похідні піримідину. Серед похідних піримідину важливу біохімічну роль виконують гідрокси- і амінопіримідини. Вони входять до складу нуклеїнових кислот, вітамінів, антибіотиків, лікарських препаратів та ін.
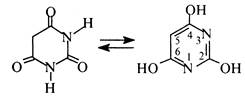 Барбітурова кислота (2,4,6-тригідроксипіримідин) це безбарвна кристалічна речовина (т. пл. 245 °С), малорозчинна у воді та етанолі, добре розчинна в діетиловому ефірі.
Барбітурова кислота (2,4,6-тригідроксипіримідин) це безбарвна кристалічна речовина (т. пл. 245 °С), малорозчинна у воді та етанолі, добре розчинна в діетиловому ефірі.
Барбітурову кислоту добувають конденсацією сечовини з малоновим ефіром (див. розд. 3.8.1, Б). Тому її можна розглядати як циклічний уреїд малонової кислоти. Барбітурова кислота є таутомерною сполукою, в якій водночас виявляються два види таутомерії кето-енольна та лактам-лактимна. Кето-енольна таутомерія зумовлена міграцією атомів водню метиленової групи, а лактам-лактимна атомів водню NH-гpуп.
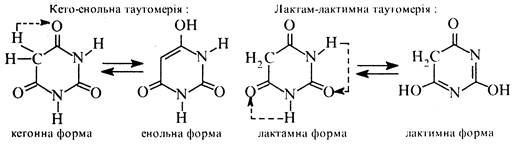
Внаслідок сумісного виявлення кето-енольної та лактам-лактимної таутомерії барбітурова кислота існує у двох таутомерних формах— триоксоформі і тригідроксиформі. За допомогою рентгено-структурного аналізу встановлено, що таутомером, який переважає, є триоксоформа.
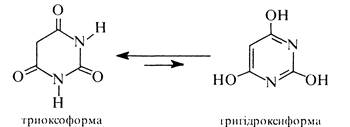
Барбітурова кислота є сильнішою кислотою, ніж оцтова. її кислотні властивості зумовлені рухливістю атомів водню ОН-груп. і особливо в гідроксилі енольного фрагмента.
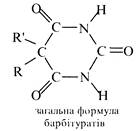 Деякі 5,5-дизаміщені похідні барбітурової кислоти застосовують в медицині як лікарські препарати, що виявляють снотворну та протисудорожну дію. Ці препарати відомі під загальною назвою барбітурати. До них відносяться:
Деякі 5,5-дизаміщені похідні барбітурової кислоти застосовують в медицині як лікарські препарати, що виявляють снотворну та протисудорожну дію. Ці препарати відомі під загальною назвою барбітурати. До них відносяться:
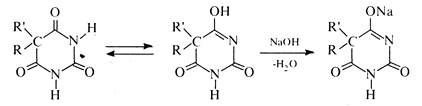
барбітал (R та R' = С2Н5), фенобарбітал (R = С2Н5, R' = С6H5), барбаміл (R= С2Н5, R' = ізо-С2Н5) та ін. Через те, що в молекулах барбітуратів атоми водню метиленової групи заміщені на вуглеводневі радикали, для них характерна тільки лактам-лактимна таутомерія. Незважаючи на це, барбітурати виявляють слабкі кислотні властивості та легко утворюють водорозчинні солі з одним еквівалентом гідроксиду натрію.
Піримідииові основи. До піримідинових основ відносять: урацил (2,4-дигідроксипіримідин), 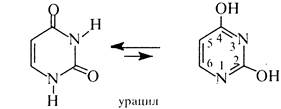
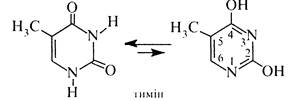
тимін (2,4-дигідрокси-5-метилпіримідим) та цитозин (4-аміно-2-гідроксипіримідим), які входять до складу нуклеїнових кислот. Ці сполуки є таутомерними речовинами та існують у лактамній та лактимній формах.
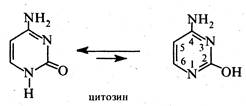 Як правило, в рівновазі переважає лактамна форма. Урацил, тимін і цитозин являють собою високоплавкі (т. пл. > 300 °С) безбарвні кристалічні речовини, малорозчинні у воді, не розчинні в етанолі та діетиловому ефірі. В клітинах організму піримідинові оснбви перебувають у вигляді N-глікозидів рибози або дезоксирибози (див. розд. 7.1),
Як правило, в рівновазі переважає лактамна форма. Урацил, тимін і цитозин являють собою високоплавкі (т. пл. > 300 °С) безбарвні кристалічні речовини, малорозчинні у воді, не розчинні в етанолі та діетиловому ефірі. В клітинах організму піримідинові оснбви перебувають у вигляді N-глікозидів рибози або дезоксирибози (див. розд. 7.1),
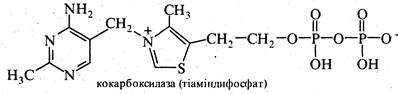
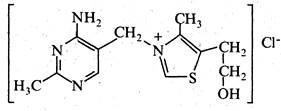 Вітамін В1(тіамін). Вітамін В1 містить у своєму складі два гетероциклічні кільця — піримідинове та тіазольне, сполучені через метиленову групу. Здобутий з природних джерел або шляхом синтезу вітамін В1 являє собою заміщену амонієву сіль. Вітамін B1 міститься у дріжджах, пшеничному хлібі, квасолі, горосі, сої, менше в картоплі, моркві та капусті. При нестачі вітаміну B1в організмі розвивається захворювання бері-бері, яке набуло поширення в ряді країн Азії та Індокитаю, де основним продуктом харчування є очищений рис.
Вітамін В1(тіамін). Вітамін В1 містить у своєму складі два гетероциклічні кільця — піримідинове та тіазольне, сполучені через метиленову групу. Здобутий з природних джерел або шляхом синтезу вітамін В1 являє собою заміщену амонієву сіль. Вітамін B1 міститься у дріжджах, пшеничному хлібі, квасолі, горосі, сої, менше в картоплі, моркві та капусті. При нестачі вітаміну B1в організмі розвивається захворювання бері-бері, яке набуло поширення в ряді країн Азії та Індокитаю, де основним продуктом харчування є очищений рис.
Вітамін В1 — безбарвна кристалічна речовина, добре розчинна у воді. Водні розчини тіаміну в кислому середовищі витримують нагрівання до високих температур без зменшення фармакологічної активності. У нейтральному та лужному середовищах вітамін B1 при нагріванні швидко руйнується.
У тваринних тканинах вільний вітамін B1 міститься у невеликих кількостях. Фізіологічно активною формою вітаміну B1 у живих організмах є кофермент кокарбоксилаза (тіаміндифосфат), що входить до складу ферментів, які беруть участь у процесах вуглеводного обміну.
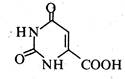 Оротова кислота (6-урацилкарбонова кислота) — безбарвна кристалічна речовина (т. пл. 345-347 °С), розчинна у воді та водних розчинах лугів.
Оротова кислота (6-урацилкарбонова кислота) — безбарвна кристалічна речовина (т. пл. 345-347 °С), розчинна у воді та водних розчинах лугів.
Оротова кислота міститься у тваринних тканинах і рослинах. Особливо багаті на неї дріжджі, печінка та молоко. Оротова кислота є попередником у біосинтезі піримідинових основ — урацилу, цитозину і тиміну. У вигляді калієвої солі (оротат калію) оротова кислота застосовується в медицині як стимулятор обмінних процесів при захворюваннях серця, печінки, жовчних шляхів та ін.
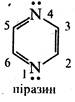
В. Піразин (1,4-діазин)
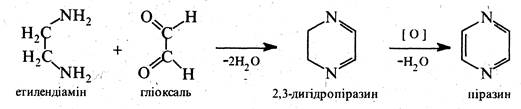
 За фізичними властивостями піразин являє собою безбарвну кристалічну речовину (т. пл. 57 °С) зі слабким запахом, розчинну у воді, етанолі, діетиловому ефірі. Піразин та його похідні добувають конденсацією 1,2-діамінів з 1,2-4икарбонільними сполуками, наприклад:
За фізичними властивостями піразин являє собою безбарвну кристалічну речовину (т. пл. 57 °С) зі слабким запахом, розчинну у воді, етанолі, діетиловому ефірі. Піразин та його похідні добувають конденсацією 1,2-діамінів з 1,2-4икарбонільними сполуками, наприклад:
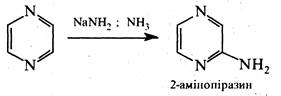
Аналогічно піридазину та піримідину, піразин є слабкою основою та утворює солі за участю одного атома азоту, в реакції електрофільного заміщення вступає насилу, реакції нуклеофільного заміщення ідуть досить легко. При дії на піразин амідом натрію в рідкому аміаці утворюється 2-амінопіразин.
Під дією пероксикислот піразин окислюється з утворенням моно-та ди-N-оксидів:
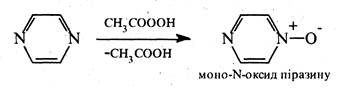
При відновленні піразину натрієм в етанолі або каталітичному гідруванні утворюється гексагідропіразин або піперазин:
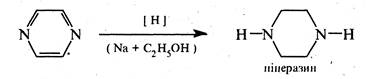
Піперазин, на відміну від піразину, є сильною двокислотною основою. Йому характерні властивості вторинних аліфатичних амінів. Сіль піперазину з адипіновою кислотою під назвою «Піперазину адипінат» застосовується в медицині як протиглисний засіб.
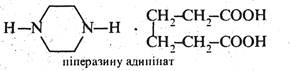
 2015-07-14
2015-07-14 4806
4806








