Создателем теории химического строения был великий русский химик
А.М.Бутлеров. Основные положения своей теории он сформулировал в 1858-1861
г.г. Некоторая трудность для нас заключается в том, что создатель теории
строения не формулировал пункт за пунктом положения своей теории в одном
месте: они пронизывают все научное творчество самого Бутлерова и его
учеников.
1. Атомы в органических молекулах связаны друг с другом в определенном
порядке химическими силами. Этот порядок Бутлеров и называл химическим
строением. Во времена Бутлерова лишь в общих словах называли эти силы «силами
валентности»: в наше время выяснено, что силы валентности имеют электронную
природу.
2. Строение можно изучить экспериментально, используя химические методы –
анализ и синтез. В наше время при установлении строения широко используют также
физические методы – разные виды оптической спектроскопии, рентгенографию,
электронографию, определение дипольных моментов. Физические методы, в первую
очередь рентгенография и электронография, позволяют определить реальное
положение каждого атома в молекуле, получать как бы его фотографию. Это
расположение согласуется с найденным чисто химическим путем. Поэтому мы чаще
говорим просто о строении молекул, опуская прилагательное «химическое»,
которое обязательно употреблял Бутлеров.
3. 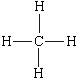

Формулы строения выражают порядок химической связи атомов. В формулах строения
(структурных формулах) символы элементов соединяют черточками, условно
изображающими химическую связь, например:
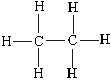
Структурные формулы в развернутой записи (т.е. с обозначением каждого атома и
каждой связи) уже при небольшом усложнении молекулы становится трудно
читаемыми. Поэтому с самого начала необходимо привыкнуть к структурным
формулам в сокращенной записи, например:
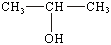
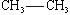
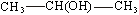 или
или
Как видно из приведенных примеров, при сокращенной записи рядом с атомом
углерода помещают непосредственно связанные с ним атомы и группы, затем ставят
черточку и после нее переходят к другому атому углерода, со стоящими при нем
заместителями. Чтобы еще более сократить запись, иногда совсем опускают
черточки: например, СН3СН(ОН)СН3.
При построении структурных формул органических соединений необходимо
учитывать найденную опытным путем валентность элементов-органогенов. Так,
валентность углерода 4, водорода 1, кислорода 2, галогенов 1. Азот, сера и
фосфор могут находиться в разных валентных состояниях.
4. Каждое вещество имеет одну определенную формулу строения, отражающую
порядок химической связи атомов в реально существующей молекуле. Это
положение глубоко материалистично, философски правильно: в основе лежит
реально существующий в природе объект – молекула, и структурная формула
должна возможно точнее отразить этот объект. Выполнению этого требования
подчинены все современные «усовершенствования» в написании формул
органических веществ – введение в них обозначений электронных пар, стрелок,
пунктиров, знаков заряда. Все это улучшает соответствие между формулой и
реальной молекулой, т.е. отвечает принципам теории строения.
5. Связанные в молекуле атомы оказывают друг на друга взаимное влияние:
свойство каждого атома в составе молекулы зависит не только от его
собственной природы, но и от окружения, в котором этот атом находится. С
взаимным влиянием атомов мы постоянно встречались во всем курсе органической
химии. Пока ограничимся простейшим примером: и в молекуле воды, и в молекуле
хлористого водорода имеется атом водорода, но сколь различны его свойства в
обоих веществах!
6. Физические и химические свойства органических соединений определяются
составом и строением их молекул. Во времена Бутлерова можно было судить лишь
о химическом строении – порядке химической связи атомов. В настоящее время
имеется возможность определять пространственное строение; определять
распределение электрических зарядов – электронное строение. Все три
особенности строения важны при рассмотрении свойств органических соединений.
Теория химического строения позволила понять природу изомерии: молекулы
структурных изомеров имеют одинаковый состав, но различаются порядком связи
атомов. Например, формула С2Н6О отвечает двум различным
веществам: диметиловому эфиру и этиловому спирту.
Бутлеров не ограничился лишь теоретическим объяснении изомерии на основе
теории строения. Он провел и ряд экспериментальных работ, подтвердив
предсказания теории получением изобутана и третичного бутилового спирта.
 2015-07-14
2015-07-14 1527
1527








