1. Процессы, протекающие на границе металл – раствор электролита (ДЭС).
2. Механизмы ЭХК.
4. Факторы, вызывающие электрохимическую гетерогенность металлической поверхности.
5. Типы коррозионных элементов.
6. Кинетика коррозионных процессов.
Первопричиной ЭХК – термодинамическая неустойчивость металла при их контакте со средой. Источником энергии для разрыва электронов является гидратация. Способность ион - атома переходить в раствор характеризуется рабочей функцией, представляющей собой скачок потенциала на границе металл-вакуум. Чем больше рабочая функция, тем сильнее связь электрон-металл.
Для ионизации металла необходимо, чтобы энергия гидратация была больше, чем рабочая функция (например, для алюминия – в 11 раз, для цинка – в 5 раз, для серебра – в 1,04 раза).
Схема двойного электрического слоя:
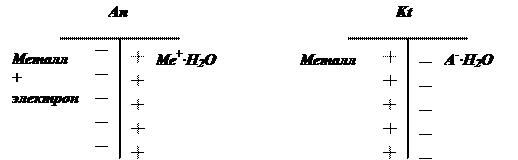
При удалении электронов и Ме+∙nН2О из двойного электрического слоя коррозия идет.
При равновесных условиях мы имеем ток обмена Aэ.в<Wг.э. в (как конденсатор).
Механизм электрохимической коррозии:
1) анодный процесс – переход металлических ионов в раствор с оставлением соответствующего количества избыточных электронов на поверхности металла:
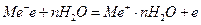 ;
;
2) катодный процесс – ассимиляция избыточных электронов ионами, атомами или молекулами электролита (деполяризаторами), которые при этом восстанавливаются:
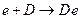 .
.
Гетерогенно-электрохимический и гомогенно-электрохимический механизмы обычно накладываются, реализуясь одновременно.
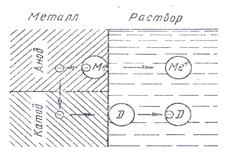
При погружении металла в раствор между ними возникает разность потенциалов, называемая потенциалом электрода Е, которая является энергетической характеристикой двойного электрического слоя. Относительную величину Е определяют электродом сравнения. В качестве основного электрода сравнения принят так называемый стандартный водородный электрод, представляющий собой электрод из черненой (платинированной) платины, погруженный в раствор кислоты с активностью ионов водорода, равной 1 г∙ион/л. Через раствор продувается водород под давлением 1,013∙105 Н/м2. Пузырьки водорода адсорбируются на платине, образуя как бы «водородную» пластинку, которая, подобно металлу, обменивает с раствором положительные ионы.
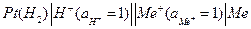 .
.
Используются также хлорсеребряный электрод (Ag+KCl) и каломельный электрод (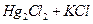 ).
).
Величина равновесного электродного потенциала может быть рассчитана по уравнению Нернста:
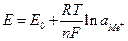 ,
,
где Е0 – стандартный потенциал электрода,
R – газовая постоянная,
n – валентность иона металла,
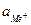 - активность ионов металла в г∙ион/л.
- активность ионов металла в г∙ион/л.
Неравновесный электродный потенциал определяют экспериментально.
При погружении двух металлов возникает разность потенциалов. Один из них выступает в качестве An, а другой – в качестве Kt.
Каждый гальванический элемент характеризуется определенной электродвижущей силой U=Ek - Ea. В результате возникает ЭДС и протекает ток.
Для элемента, составленного из медного и цинкового электродов, имеем:
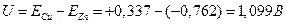 .
.
К основным факторам, вызывающих электрохимическую гетерогенность металлических поверхностей, относятся:
1) неоднородность металлической фазы:
– макро- и микронеоднородность поверхности металла;
– неоднородность защитных пленок;
– неоднородные деформации и внутренние напряжения;
2) неоднородность жидкой фазы;
3) неоднородность физических условий (температура, лучистая энергия, электрическое поле).
Типы коррозионных элементов:
1. Элементы, состоящие из двух разных металлов, погруженных в растворы различных электролитов.
2. Элементы, образованные при погружении электродов одного и того же металла в растворы различных электролитов или в растворы одного и того же электролита, различающиеся концентрацией, температурой, скоростью движения или другими факторами.
3. Элементы, образующиеся при погружении двух разных металлов в раствор одного и того же электролита.
Процесс электрохимической коррозии, возникающий вследствие контакта гетерогенной металлической поверхности с раствором электролита, сопровождается перетеканием электрического тока от анодных участков к катодным участкам в металле и от катодных участков к анодным в электролите. Объясняется это начальной разностью потенциалов катодной и анодной составляющих.
Значение коррозионного тока в момент замыкания цепи определяется по закону Ома:
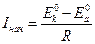 .
.
Установившийся коррозионный ток:
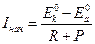 ,
,
где Р – поляризационное сопротивление,
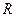 - омическое сопротивление,
- омическое сопротивление,
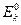 - начальное значение потенциала катода до замыкания цепи,
- начальное значение потенциала катода до замыкания цепи,
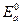 - начальное значение потенциала анода до замыкания цепи.
- начальное значение потенциала анода до замыкания цепи.
Т.е. 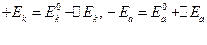 .
.
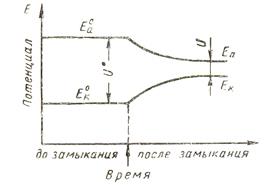
Уменьшение разности начальных значений потенциалов коррозионного элемента вследствие протекания тока называется поляризацией, при котором скорость коррозии уменьшается.
Уменьшение поляризуемости электродов называется деполяризацией. Она увеличивает скорость коррозионных процессов
По степени поляризуемости электрода можно судить о скорости протекания коррозионного процесса. Таким образом, о кинетике электродных процессов можно судить по зависимости между смещением потенциала электрода Е и величиной плотности протекающего тока i=I/S.
Зависимость потенциала электрода от плотности проходящего тока через него тока, изображенная графически, называется поляризационной кривой. В зависимости от того, в какую сторону от стационарного потенциала смещать потенциал электрода, можно получать анодные или катодные поляризационные кривые. При потенциалах отрицательнее стационарного потенциала получается катодная поляризационная кривая, при потенциалах положительнее стационарного потенциала – анодная поляризационная кривая.
Основные причины анодной поляризации:
– выход Ме+ в раствор не поспевает за отводом электронов, и потенциал металла сдвинется в положительную сторону (перенапряжение металла);
– увеличение концентрации Ме+ на поверхности из-за уменьшенной скорости диффузии (концентрационная поляризация);
– образование пассивных пленок.
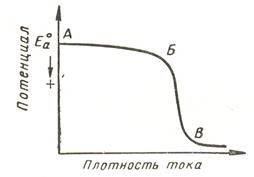
АБ – активный раствор металла, Б – начало образования пленки, В – конец образования пленки и пассивное состояние.
Методы измерения анодных поляризационных кривых:
1) гальваностатический метод E=f(i), который заключается в том, что на электрод накладываются различные плотности анодного тока и при этом фиксируются устанавливающиеся значения потенциала электрода;
2) потенциостатический метод i=f(E) заключается в том, что исследуемый электрод искусственно поддерживается с помощью специального прибора – потенциостата при постоянном во времени потенциале, а наблюдение ведется за меняющейся во времени величиной анодного тока.
Причины катодной поляризации:
– медленность течения электрохимической реакции связывания D+e (перенапряжение катодной реакции);
– малая скорость диффузии Д на поверхности катода.
 2015-07-14
2015-07-14 3296
3296








