1. Сульфосалициловая кислота, раствор концентрацией 10 % (мас.).
2.
|
3. Серная кислота, 0,5 моль/дм3 раствор.
4. Аммиак, раствор с концентрацией 10% (мас.).
5. Универсальная индикаторная бумага.
Посуда.
1. Колбы мерные вместимостью 50 см3 – 7 шт., 1000 см3 – 1 шт.
2. Пипетки градуированные вместимостью 1, 5 и 10 см3 – по 1 шт.
3. Пипетка Мора вместимостью 25 см3.
Аппаратура.
1. Фотоэлектроколориметр или спектрофотометр, кюветы с толщиной светопоглощающего слоя 1 см.
2. Аналитические весы.
Ход определения
Для построения градуировочного графика в 6 мерных колб градуированной пипеткой помещают последовательно 0; 2; 4; 6; 8 и 10 см3 стандартного раствора железоаммонийных квасцов. В каждую колбу добавляют по 3,0 см3 раствора сульфосалициловой кислоты и 1,0 см3 серной кислоты, доводят дистиллированной водой до метки, перемешивают. Получают серию окрашенных в красно-фиолетовый цвет растворов, содержащих 50 см3 соответственно 0; 0,2; 0,4; 0,6; 0,8 и 1,0 мг Fe3+.
|
|
|
Оптическую плотность растворов измеряют на спектрофотометре при длине волны 510 нм или на фотоэлектроколориметре при светофильтре № 5; контроль – раствор, содержащий все указанные реактивы, кроме Fe3+. Полученные данные оформляют в виде таблицы 1. По полученным данным строят градуировочный график в координатах: содержание Fe3+, мг/50 см3 – оптическая плотность раствора.
Таблица 1
| № | Fe3+, мг/50 см3 | А |
| 0,2 | ||
| 0,4 | ||
| 0,6 | ||
| 0,8 | ||
| 1,0 |
В мерную колбу вместимостью 50 см3 помещают 25 см3 анализируемой питьевой воды, добавляют 3,0 см3 раствора сульфосалициловой кислоты и 1,0 см3 серной кислоты, доводят дистиллированной водой до метки, перемешивают. Измеряют оптическую плотность полученного раствора в приведённых выше условиях, по градуировочному графику находят содержание Fe3+ в 50 см3 раствора, т.е. в 25 см3 анализируемой питьевой воды.
Содержание Fe3+ (Q, мг/дм3) рассчитывают по формуле
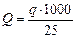 (6)
(6)
где q – масса Fe3+ в 25 см3 анализируемой питьевой воды, мг.
Полученные данные оформите в виде таблицы 2:
Таблица 2
| № раствора | А | Fe3+, мг/дм3 |
Методика применима для определения Fe3+ в присутствии Cu2+. Аналогично определяют Fe3+ в аммонийной среде, при этом вместо соляной кислоты добавляют раствор аммиака. Оптическую плотность окрашенных в жёлтый цвет растворов измеряют на спектрофотометре при длине воны 425 нм или на фотоэлектроколориметре при светофильтре № 2.
|
|
|
Дополнительные задания:
 2015-07-14
2015-07-14 890
890








