1. Гидролиз сложных эфиров:
| |
2. Из солей карбоновых кислот:
| |
*3. Растворением ангидридов карбоновых кислот в воде:
| |
*4. Щелочной гидролиз галогенангидридов:
|
| 7. Общие способы получения карбоновых кислот | |
1. Окисление альдегидов:
Например, реакция «Серебряного зеркала» или окисление гидроксидом меди (II) – качественные реакии альдегидов | |
2. Окисление спиртов:
| |
| *3. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода. 3NaOH R-CCl3 → [R-C(OH)3] → R-COOH + H2O -3NaCl | |
| *4. Из цианидов (нитрилов) –способ позволяет наращивать углеродную цепь: СH3-Br + Na-C≡N → CH3-CN + NaBr метилцианид (нитрил уксусной кислоты) t СH3-CN + 2H2O → CH3COONH4 ацетат аммония CH3COONH4 + HCl → CH3COOH + NH4Cl | |
| *5. Использование реактива Гриньяра H2O R-MgBr + CO2 → R-COO-MgBr → R-COOH + Mg(OH)Br |
8. ПРЕДЕЛЬНЫЕ ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
CnH2n+1-COOH или CnH2nO2
Строение карбоксильной группы
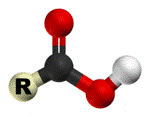
Карбоксильная группа сочетает в себе две функциональные группы — карбонил
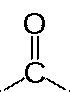
и гидроксил -OH, взаимно влияющие друг на друга.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О-Н.
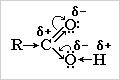
В водном растворе карбоновые кислоты диссоциируют на ионы:
R-COOH = R-COO- + H+
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
| 9. Химические свойства карбоновых кислот | |
| Общие с другими кислотами | 1. Диссоциация: R-COOH ↔ RCOO- + H+ -Сила кислот уменьшается в ряду: H-COOH > CH3-COOH > CH3-CH2-COOH |
| 2. Взаимодействие с активными металлами: 2R-COOH + 2Na → 2R-COONa + H2↑ | |
| 3. Взаимодействие с основными оксидами и основаниями: 2R-COOH + CaO → (R-COO)2Ca + H2O R-COOH + NaOH → R-COONa + H2O | |
| 4. Взаимодействие с солями слабых кислот: R-COOH + NaHCO3 → R-COONa + H2O + CO2↑ -Соли карбоновых кислот разлагаются сильными минеральными кислотами: R-COONa + HСl → NaCl + R-COOH -В водных растворах гидролизуются: R-COONa + H2O ↔ R-COOH + NaOH | |
| Специфические свойства | *1. Образование функциональных производных R-CO-X (свойства гидроксильной группы) Получение хлорангидридов: R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl |
| 2. Взаимодействие со спиртами (этерификация): H2SO4 R-COOH + R1-OH ↔ R-CO-OR1 | |
| 3. Реакции замещения с галогенами (свойства углеводородного радикала): красный фосфор R-CH2-COOH + Cl2 → R-CH-COOH+ HCl │ Cl 2 -хлорпроизводное карбоновой кислоты | |
4. Особенности муравьиной кислоты H-COOH:
| |
| 5. Реакции декарбоксилирования солей карбоновых кислот (получение алканов): t R-COONa + NaOH → Na2CO3 + R-H(алкан) | |
| 6. Окисление в атмосфере кислорода: R-COOH + O2 → CO2 + H2O |
 2015-07-14
2015-07-14 1662
1662
