ТЕМА 6
| № воп роса | Мар- кер | Вопрос-ответ |
| V | Что называется скоростью химической реакции? | |
| + | Изменение количества вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице реакционного пространства: 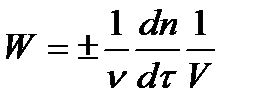 | |
| - | Изменение количества вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в произвольном объёме | |
| - | Изменение концентрации исходного вещества или продукта в ходе протекания реакции. | |
| - | Скорость реакции – это пробег молекул за единицу времени: 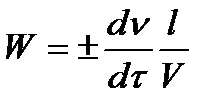 | |
| V | Какие факторы влияют на скорость химической реакции? | |
| + | Природа и концентрация реагирующих веществ, наличие катализатора, природа растворителя, температура. | |
| - | Только природа реагирующих веществ | |
| - | Только концентрация реагирующих веществ | |
| - | Только температура раствора | |
| V | Как формулируется основной постулат химической кинетики? | |
| - | Общая скорость сложного процесса, состоящего из ряда последовательных стадий, определяется скоростью наиболее медленной стадии. | |
| - | Константа скорости реакции численно равна скорости, если концентрации реагирующих веществ постоянны и равны единице. | |
| + | Скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ в некоторых степенях. | |
| - | Порядок реакции определяется как сумма степеней, входящих в уравнение типа W = kC1q C2pC3r | |
| V | Что такое молекулярность реакции? | |
| - | Это число молекул, последовательно взаимодействующих в ходе сложных химических реакции. | |
| - | Это число взаимодействующих молекул в соответствии с общим уравнением реакции. | |
| + | Это число молекул, одновременно взаимодействующих в элементарных актах химических превращений. | |
| - | Это теоретическая величина, равная порядку реакции. | |
| V | Какие значения принимает порядок реакции? | |
| + | Порядок реакции может быть целочисленным, положительным, дробным, отрицательным. | |
| - | Численные значения порядка реакции ограничены лишь тремя числами: 1,2,3. | |
| - | Значения порядка реакции совпадают с молекулярностью реакции. | |
| - | Любые значения, кроме нуля. | |
| V | Что называют константой скорости реакции? | |
| - | Константа скорости реакции численно равна порядку реакции. | |
| - | Константа скорости реакции – это величина, которая в каждый момент времени пропорциональна произведению текущих концентраций реагирующих веществ | |
| + | Константа скорости численно равна скорости данной реакции при концентрациях реагирующих веществ равных единице. | |
| - | Константа скорости реакции численно равна скорости, если концентрации реагирующих веществ постоянны. | |
| V | От каких параметров зависит константа скорости реакции? | |
| - | От концентрации реагирующих веществ. | |
| - | От концентрации реагирующих веществ и температуры. | |
| + | От температуры и наличия катализатора. | |
| - | От концентрации реагирующих веществ и наличия катализатора. | |
| V | Какое из приведенных решений дифференциальных уравнений соответствует реакции первого порядка? | |
| - | C = C0 – kτ | |
| - | 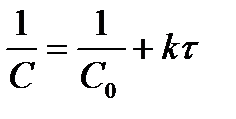 | |
| - | 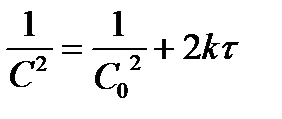 | |
| + | lnC = lnC0 – kτ | |
| V | По какому уравнению можно рассчитать константу скорости реакции первого порядка? | |
| - | 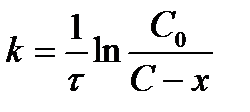 | |
| - | 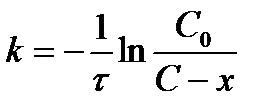 | |
| + | 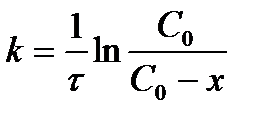 | |
| - | 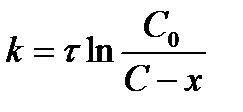 | |
| V | Каким уравнением описывается зависимость концентрации исходного вещества от времени для реакции первого порядка? | |
| - | C = C0 – kτ | |
| - | 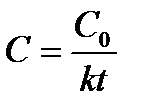 | |
| + | 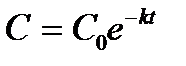 | |
| - | 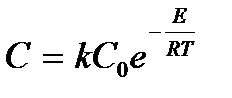 | |
| V | Что такое период полупревращения? | |
| - | Это величина порядка реакции, деленная на два. | |
| + | Это время, за которое в ходе реакции реагирует половина исходного вещества. | |
| - | Это половина времени протекания реакции. | |
| - | Это величина константы скорости реакции, деленная на два. | |
| V | Какую зависимость отражает кинетическая кривая? | |
| - | Зависимость скорости реакции от времени. | |
| + | Зависимость концентрации реагентов от времени. | |
| - | Зависимость скорости реакции от температуры. | |
| - | Зависимость константы скорости реакции от температуры. | |
| V | Какие реакции называются двусторонними (обратимыми)? | |
| + | Реакции, которые протекают одновременно в противоположных направлениях | |
| - | Реакции, для которых выполняется закон действующих масс. | |
| - | Реакции, для которых при достижении равновесия концентрацией исходных веществ можно пренебречь. | |
| - | Реакции, для которых закон действующих масс не выполняется. | |
| V | Какой рисунок отвечает кинетическим кривым для обратимой реакции первого порядка А  В, если значение константы равновесия К > 1? В, если значение константы равновесия К > 1? | |
| + |  | |
| - |  | |
| - |  | |
| - |  | |
| V | Какой рисунок соответствует кинетическим кривым для А и В в обратимой реакции первого порядка А  В, если Сb,0=0? В, если Сb,0=0? | |
| - | 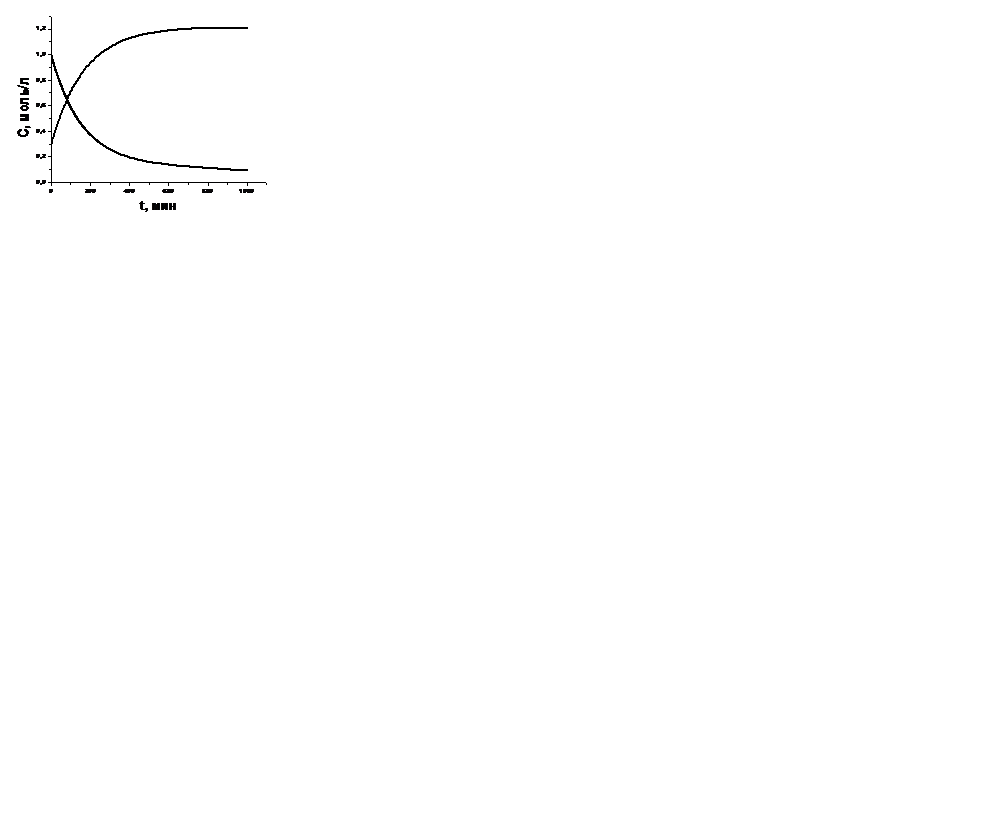 | |
| + |  | |
| - |  | |
| - |  | |
| V | Какие реакции называются параллельными? | |
| + | Реакции, которые протекают по нескольким направлениям с участием одних и тех же реагирующих веществ и образованием различных продуктов. | |
| - | Реакции, в которых продукт, образующийся в одной реакции, является исходным веществом для следующей реакции. | |
| - | Реакции, когда самопроизвольно идущая в системе реакция вызывает протекание другой, неосуществимой в отсутствии первой. | |
| - | Реакции, протекающие в присутствии катализатора. | |
| V | Нарисуйте кривые зависимости концентраций веществ А, В, С от времени для параллельной необратимой реакции  , если k1> k2 , если k1> k2 | |
| - | 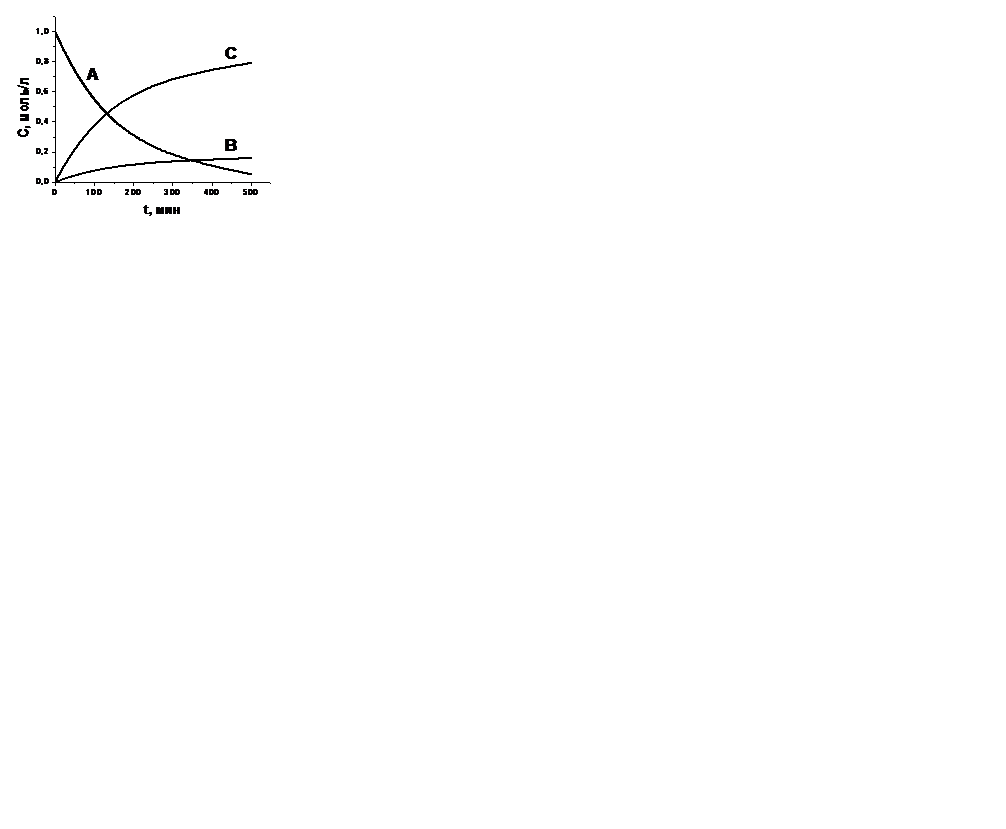 | |
| + | 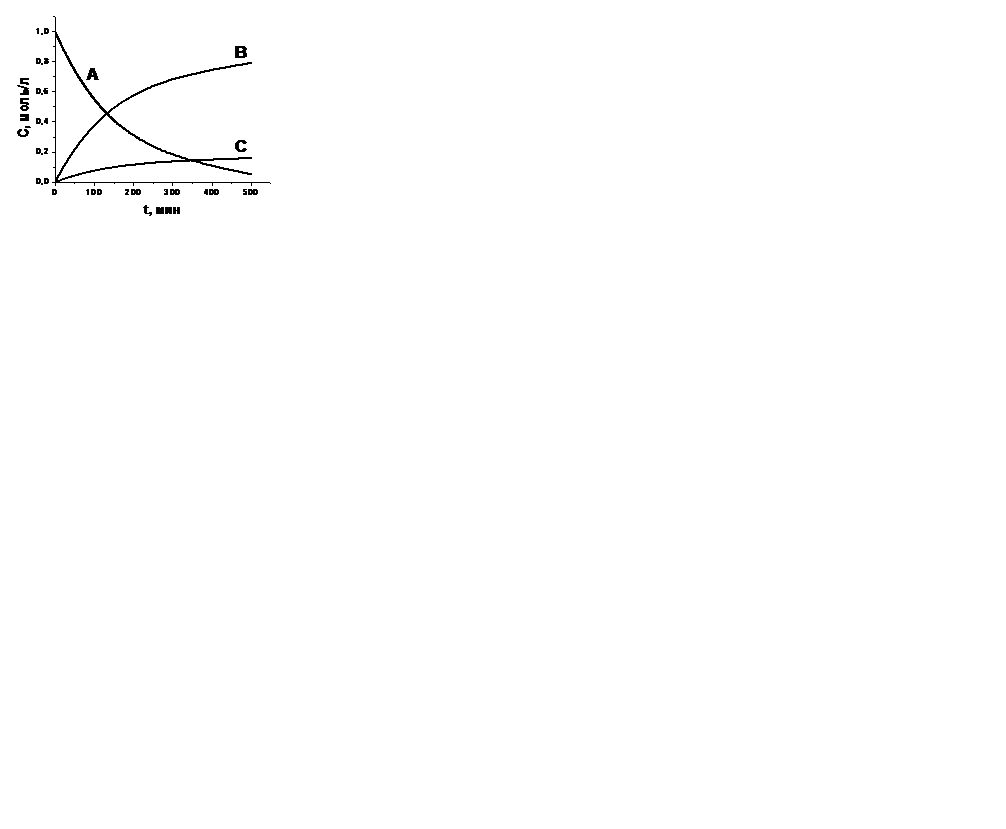 | |
| - |  | |
| - |  | |
| V | Какие реакции называются последовательными? | |
| - | Реакции, которые протекают по нескольким направлениям с участием одних и тех же реагирующих веществ и образованием различных продуктов. | |
| + | Реакции, в которых продукт, образующийся в одной реакции, является исходным веществом для следующей реакции. | |
| - | Реакции, когда самопроизвольно идущая в системе реакция вызывает протекание другой, неосуществимой в отсутствии первой. | |
| - | Реакции, протекающие в присутствии катализатора. | |
| V | Изобразите графически изменение концентрации со временем участников последовательной реакции 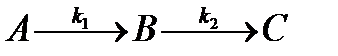 . . | |
| + | 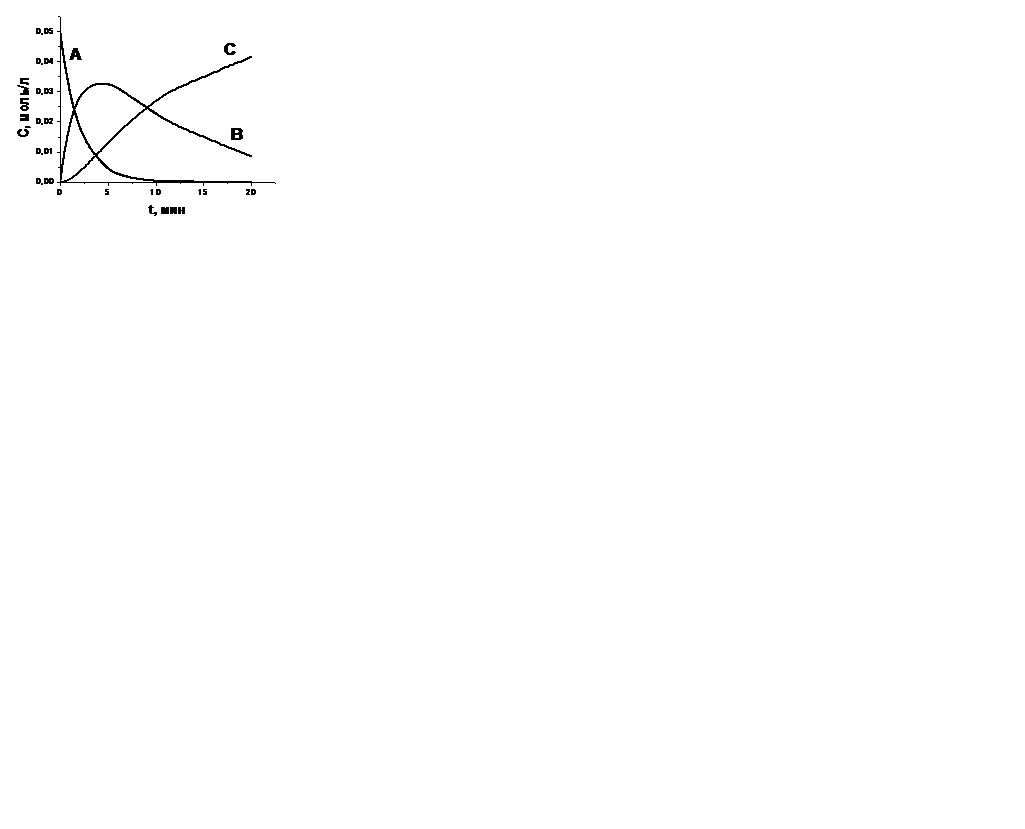 | |
| - |  | |
| - |  | |
| - |  | |
| V | Скорость химической реакции с ростом температуры: | |
| - | Не изменяется | |
| + | Увеличивается. | |
| - | Уменьшается. | |
| - | Зависимость носит экстремальный характер. | |
| V | Как формулируется правило Вант-Гоффа? | |
| + | При повышении температуры на 10 градусов скорость гомогенных химических реакций увеличивается в 2-4 раза. | |
| - | Скорость реакции пропорциональна концентрации с учётом порядка реакции. | |
| - | При термическом возбуждении активация происходит за счёт обмена энергией в результате столкновения молекул: | |
| - | Величина энергии активации зависит от энергетического состояния молекул, вступающих в химическую реакцию. | |
| V | Какое значение может принимать температурный коэффициент согласно принципу Вант-Гоффа? | |
| - | 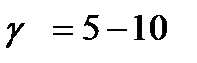 | |
| + | 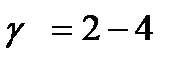 | |
| - | 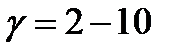 | |
| - | 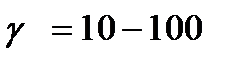 | |
| V | Какое из приведенных уравнений является уравнением Аррениуса? | |
| + | 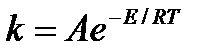 | |
| - | 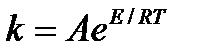 | |
| - | 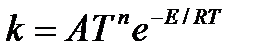 | |
| - | 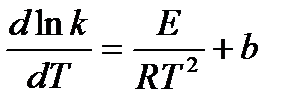 | |
| V | Какой физический смысл энергии активации? | |
| - | Энергия активации – это средняя величина энергии реагирующих молекул. | |
| - | Энергия активации – это максимальная энергия, которой может обладать молекула, принимающая участие в данной химической реакции | |
| + | Энергия активации представляет собой избыточное количество энергии (по сравнению со средней величиной), которым должна обладать молекула, чтобы прореагировать в данной химической реакции. | |
| - | Энергия активации представляет собой минимальную энергию, которой должна обладать молекула, чтобы прореагировать в данной химической реакции. | |
| V | В каком случае правильно указана энергия активации прямой реакции? | |
| - | 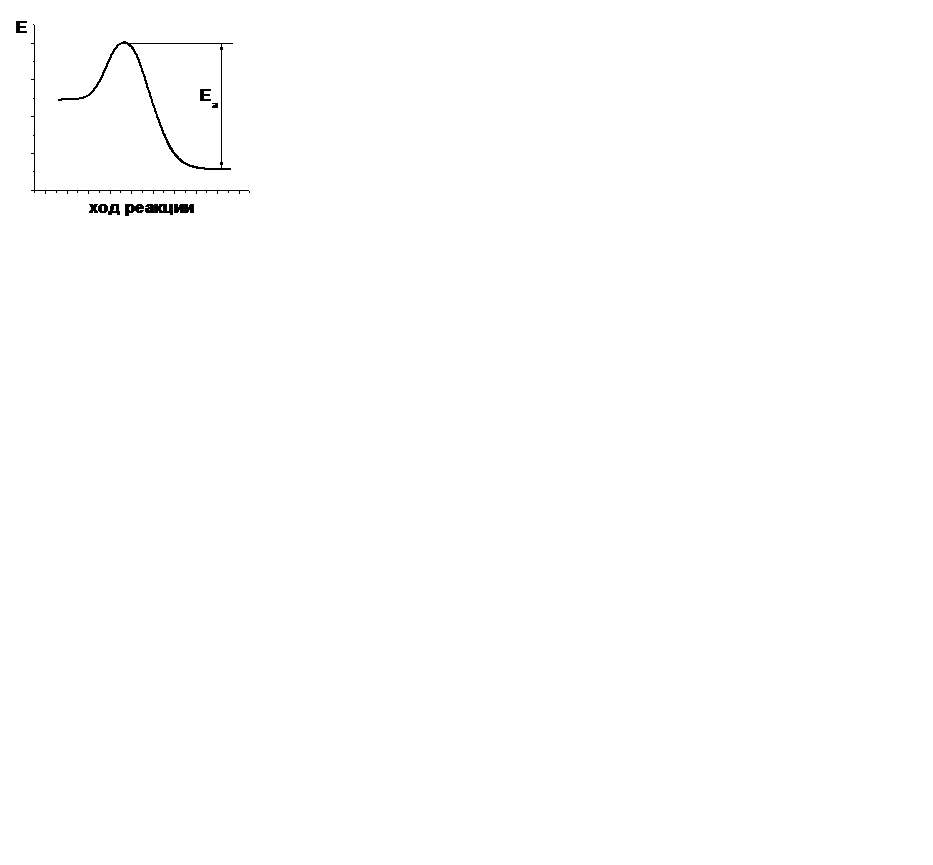 | |
| - | 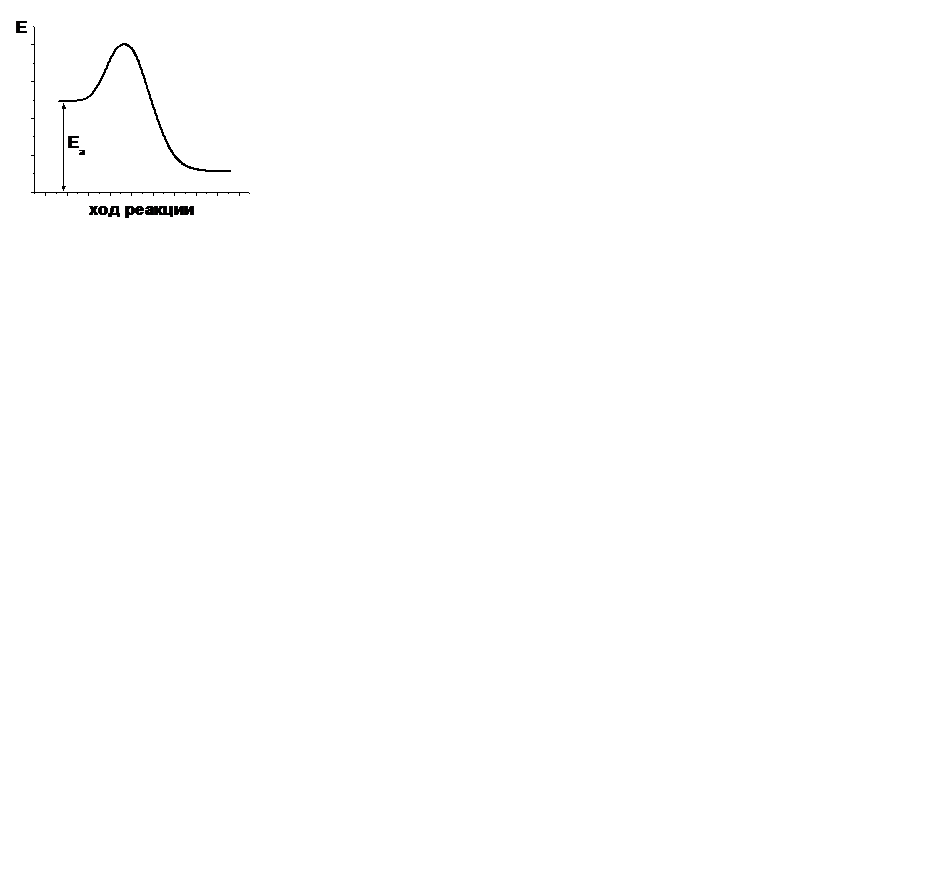 | |
| + | 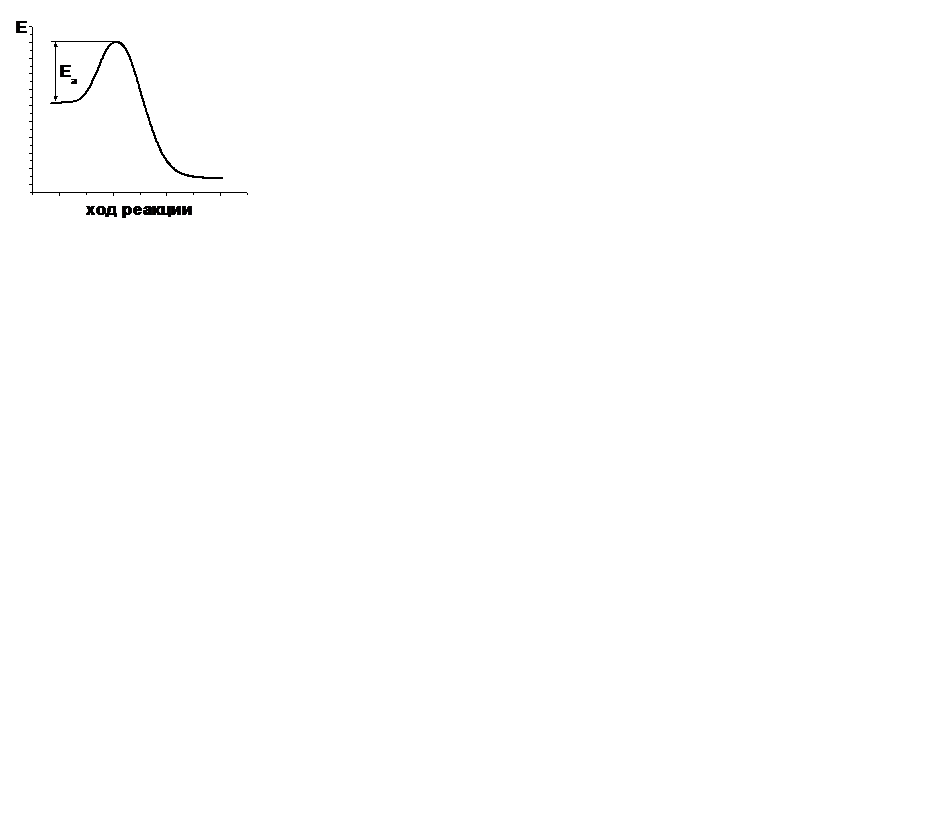 | |
| - | 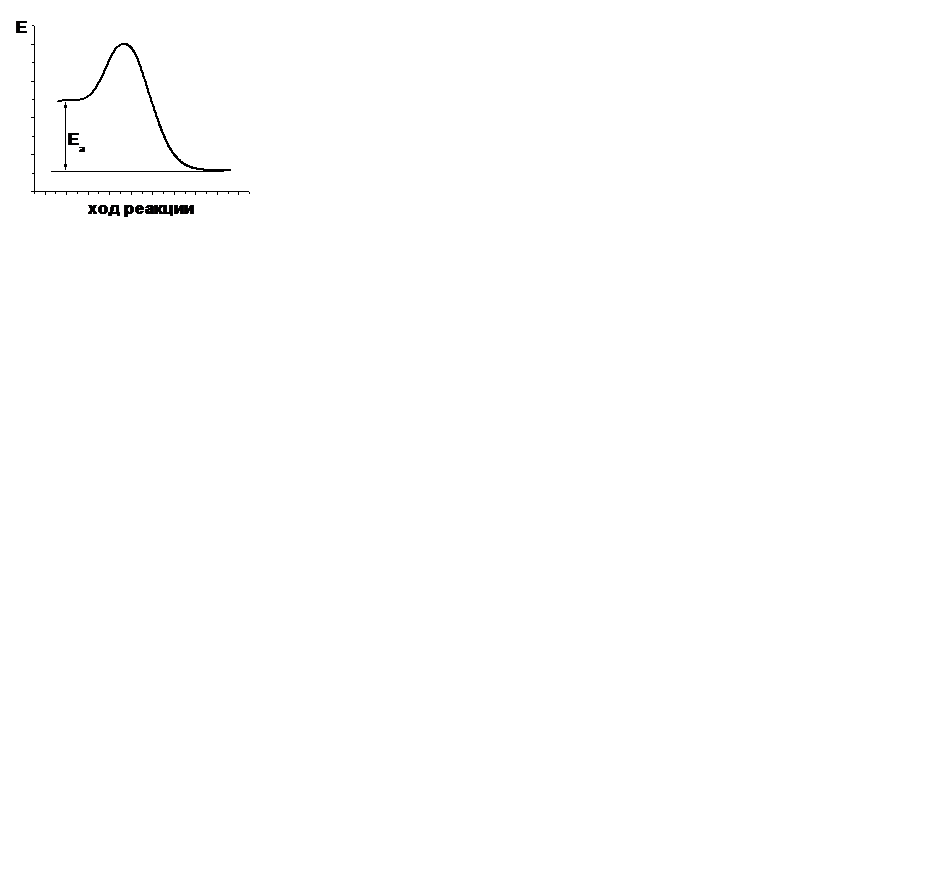 | |
| V | Какие реакции называются цепными? | |
| - | реакции, протекающие одновременно в прямом и обратном направлениях, но с разной скоростью | |
| - | реакции, протекающие на границе проводник первого рода – проводник второго рода с участием электронов | |
| - | реакции, в которых исходное вещество одновременно расходуется по нескольким путям с образованием разных продуктов | |
| + | реакции, протекающие через ряд регулярно повторяющихся элементарных стадий с участием радикалов, атомов или других активных частиц | |
| V | Какая стадия является первичной в любом цепном процессе? | |
| - | стадия столкновения молекул | |
| + | стадия образования активной частицы | |
| - | стадия разрыва химической связи | |
| - | стадия поглощения кванта энергии | |
| V | Какие стадии можно выделить в любой цепной реакции? | |
| - | световую стадию и темновые стадии | |
| - | поглощение энергии извне, взаимодействие активных частиц и образование продуктов реакции | |
| - | образование активированного комплекса и его распад с образованием продукта реакции | |
| + | зарождение цепи, развитие цепи, обрыв цепи | |
| V | Цепная реакция с неразветвленной цепью это: | |
| + | реакция, в которой одна активная частица при своем взаимодействии вызывает образование только одной новой активной частицы | |
| - | реакция, в которой в результате одного элементарного акта регенерируется две или больше активных частиц | |
| - | реакция с ограниченной длиной цепи | |
| - | реакция, протекающая одновременно в прямом и обратном направлениях, но с разной скоростью | |
| V | Квантовый выход это: | |
| - | доля продиссоциировавших молекул из числа первоначально взятых | |
| + | отношение числа действительно прореагировавших молекул к числу поглощенных квантов | |
| - | число молекул данного исходного вещества, которые прореагировали в результате одного элементарного акта зарождения цепи | |
| - | число молекул исходного вещества, поглотивших квант энергии | |
| V | От каких факторов и как зависит скорость собственно фотохимической реакции? | |
| - | растет с увеличением концентрации реагентов, давления и температуры | |
| - | растет с уменьшением концентрации реагентов, ростом температуры и интенсивности падающего света | |
| + | пропорциональна интенсивности падающего света, растет с увеличением концентрации реагентов и длиной пути излучения в веществе | |
| - | обратно пропорциональна длине волны падающего света и прямо пропорциональна концентрации реагентов | |
| V | Как называют вещество, изменяющее скорость реакции, участвующее в образовании активированного комплекса и не входящее в состав конечных продуктов? | |
| + | Катализатор | |
| - | Промотор | |
| - | Каталитический яд | |
| - | Мультиплет | |
| V | Вещество, усиливающее активность катализатора и само по себе не являющееся катализатором, называется | |
| - | Мультиплетом | |
| + | Промотором | |
| - | Каталитическим ядом | |
| - | Ингибитором | |
| V | Вещество, снижающее активность катализатора, называется | |
| - | Мультиплетом | |
| - | Промотором | |
| + | Каталитическим ядом | |
| - | Ингибитором | |
| V | Явление изменения скорости химической реакции в присутствии веществ, состояние и количество которых после реакции остаются неизменными, называется | |
| - | Автокатализом | |
| - | Катализатором | |
| - | Селективностью катализатора | |
| + | Катализом | |
| V | При введении катализатора константа равновесия химической реакции | |
| - | Увеличивается | |
| - | Уменьшается | |
| + | Не изменяется | |
| - | Данных для ответа недостаточно | |
| V | Вещество, уменьшающее скорость химической реакции, называется | |
| - | Промотором | |
| - | Каталитическим ядом | |
| + | Ингибитором | |
| - | Активным ансамблем | |
| V | Что является важнейшей причиной увеличения скорости реакции при введении в систему катализатора? | |
| - | Увеличение константы равновесия | |
| - | Увеличение энергетического барьера реакции | |
| + | Уменьшение энергии активации | |
| - | Уменьшение константы равновесия | |
| V | Разновидность катализа, в котором реагенты и катализатор находятся в одной фазе, называется | |
| - | Селективностью катализатора | |
| - | Автокатализом | |
| + | Гомогенным катализом | |
| - | Гетерогенным катализом | |
| V | Зависит ли и если да, то, как скорость гомогенно-каталитических реакций от концентрации катализатора? | |
| - | Не зависит | |
| - | Обычно достаточно очень малой концентрации катализатора для увеличения скорости | |
| + | Общая скорость гомогенно-каталитических реакций пропорциональна концентрации катализатора | |
| - | Скорость может возрастать или уменьшатся в зависимости от природы катализатора | |
| V | Что такое слитный механизм катализа? | |
| + | Когда в состав активированного комплекса входят катализатор и все реагирующие вещества | |
| - | Когда исходные вещества реагируют с катализатором и промежуточными соединениями в несколько стадий, поэтапно | |
| - | Когда реагенты и катализатор находятся в одной фазе | |
| - | Когда реагенты и катализатор находятся в разных фазах | |
| V | Что такое раздельный механизм катализа? | |
| - | Когда в состав активированного комплекса входят катализатор и все реагирующие вещества | |
| + | Когда исходные вещества реагируют с катализатором и промежуточными соединениями в несколько стадий, поэтапно | |
| - | Когда реагенты и катализатор находятся в одной фазе | |
| - | Когда реагенты и катализатор находятся в разных фазах | |
| V | Катализ, в котором каталитическим действием обладает ион гидроксония H3O+, а также любая кислота Бренстеда, называется | |
| + | Общий кислотный | |
| - | Общий основной | |
| - | Специфический основной | |
| - | Специфический кислотный | |
| V | Катализ, в котором каталитическим действием обладает исключительно ион гидроксония H3O+, называется | |
| + | Специфический кислотный | |
| - | Специфический основной | |
| - | Общий кислотный | |
| - | Общий основной | |
| V | Катализ, в котором каталитическим действием обладает ион гидроксила OН-, а также любое основание Бренстеда, называется | |
| - | Специфический кислотный | |
| - | Специфический основной | |
| - | Общий кислотный | |
| + | Общий основной | |
| V | Явление каталитического ускорения химической реакции одним из её продуктов называется | |
| - | Селективностью катализатора | |
| - | Гомогенным катализом | |
| + | Автокатализом | |
| - | Катализом | |
| V | Разновидность катализа, в котором реакции идут на поверхности раздела фаз, образуемых катализатором и реагирующими веществами, называется | |
| - | Гомогенным катализом | |
| - | Автокатализом | |
| + | Гетерогенным катализом | |
| - | Ферментативным катализом |
 2015-08-21
2015-08-21 1652
1652