Физико-химические свойства криолито-глиноземного расплава определяются свойствами его компонентов и продуктов их взаимодействия. К основным физико-химическим свойствам относятся: температура плавления, растворимость глинозема, плотность, электропроводность, вязкость, поверхностное натяжение и давление насыщенных паров.
Температура плавления определяет границу существования жидкого состояния системы, поэтому очень важна для практических целей. Знание температур плавления различных систем помогает выбрать нужные соотношения компонентов электролитов.
Используя свойство расплава скачкообразно изменять энтальпию при охлаждении в момент перехода из одного состояния в другое и измеряя во времени температуру охлаждающегося сплава, можно установить, при каком ее значении происходит то или иное превращение. Все превращения, происходящие с расплавом при изменении температуры и состава, обычно выражают графически в виде диаграммы состояния, которая представляет собой обобщение результатов всех наблюдении за данной системой расплавов.
В диаграммах состояния систем, включающих две пли более фаз, форма границы между жидким н твердым состоянием позволяет обнаружить химические соединения, возникающие между компонентами смеси, и судить о степени их термической диссоциации в расплаве. Кроме того, по форме этой границы в известной степени удастся предсказать изменение свойств смеси в зависимости от ее состава, так как максимумы и минимумы на этой границе обычно соответствуют изменениям физико-химических свойств.
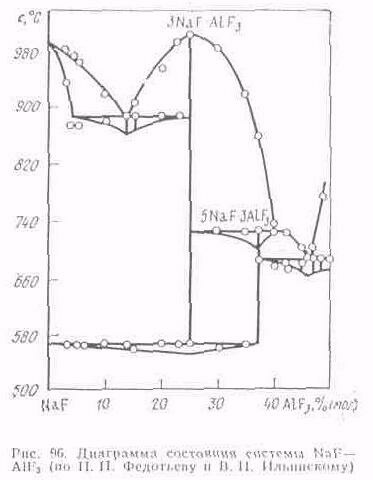
Впервые фундаментальные исследования физико-химических свойств криолито-глиноземного расплава были выполнены П. П. Федотьевым и В. П. Ильинским. Приведенная ими диаграмма состояния системы NaF—AlF3 (рис. 96) подтверждена рядом исследователей с незначительными уточнениями.
Фтористый натрии имеет температуру плавления 997°С; фтористый алюминий возгоняется при 1270 °С, не плавясь. Криолит Na3AlF6 образуется при 25 % (мол.) AlF3; температура его плавления около 1000 °С. Резко выраженный максимум, отвечающий образованию криолита, свидетельствует о прочности этого химического соединения. При 37,5 % (мол.) АlF3 образуется другое химическое соединение—хиолит 5NаF.ЗАlF3, температура плавления которого около 725°С. Это соединение непрочно и распадается при температуре его плавления на криолит и фтористый алюминий. Более поздними исследованиями и данной системе найдено еще одно химическое соединение (NaAlF4) и одна эвтектика.
На диаграмме видно, что при избытке фтористого алюминия (уменьшение криолитового отношения) в избытке фтористого натрия (увеличение криолитового отношения) понижается температура плавления расплава. Добавление к криолито-глиноземному расплаву фтористого алюминия нашло практическое использование при электролизе алюминия. Однако не следует забывать, что увеличение содержания фтористого алюминия в смеси приводит к увеличению испарения расплава. Избыточное содержание фтористого натрия также приводит к нежелательным последствиям, увеличивая вероятность выделения натрия на катоде.
Установлено, что температура плавления глинозема 2030 ºС, а алюминия технической чистоты 659 º.
Растворимость глинозема в криолите имеет большое практическое значение при использовании криолито-глиноземных распла
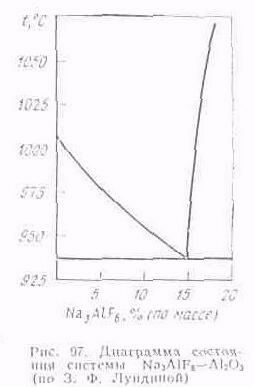
вов в качестве электролита. Система Na3AlF6—Al2O3 исследовалась многократно и различными методами. Результаты этих исследований значительно расходятся, особенно в области заэвтсктнческих сплавов. Предпочтение отдастся результатам, полученным 3. Ф. Лундиной (рис. 97). Анализ этой диаграммы состояния показывает, что глинозем значительно снижает температуру плавления криолита, по имеет ограниченную растворимость в нем. При содержании около 15 % (по массе) Al2O3 криолит с глиноземом образуют эвтектику, температура плавления которой 938 ºС. Дальнейшее незначительное растворение глинозема происходит при существенном повышении температуры расплава. При 950 °С растворимость глинозема в криолите составляет примерно 15 % (по массе).
Для снижения температуры плавления промышленною электролита в него всегда вводят некоторый избыток фтористого алюминия.
Наиболее полно тронная система Nа3AlF6— АlF3—Al2O3 исследована А. А. Костюковым (рис. 98). Эта система характеризуется четырьмя полями первичной кристаллизации —криолита, хиолита, фтористого алюминия и глинозема и двумя тронными точками—тройной эвтектической (678°С) и тройной перитектической (710 ºС). На диаграмме видно, что в области первичной кристаллизации криолита температура плавления расплавов снижается от
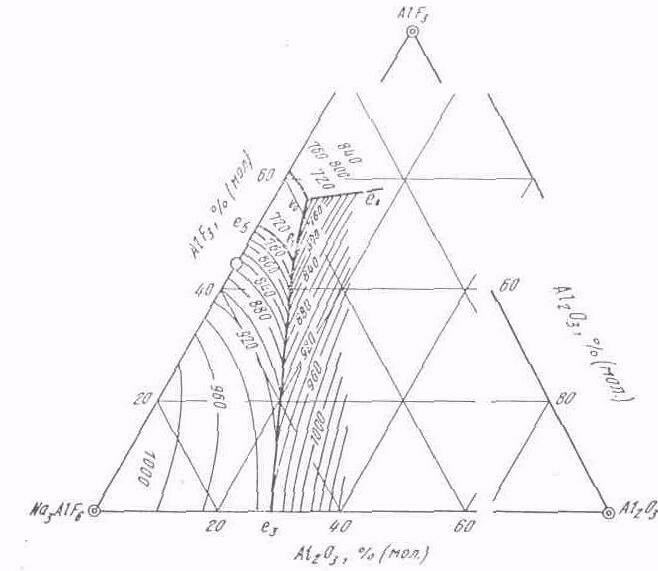
Рис. 98. Диаграмма состояния системы Nа3A1F6 - АlF3—Al2O3 (по А.А. Костюкову)
криолита к тройной переходной точке. Крутизна поверхности ликвидуса увеличивается по мере повышения концентрации фтористого алюминия в расплаве; при этом содержание глинозема в расплаве понижается.
Многочисленными исследованиями установлено, что растворимость глинозема в криолите при избыточном содержании в нем фтористого алюминия понижается. Для расплава с избытком фтористого алюминия, соответствующим криолитовому отношению 2,2—2,4, растворимость глинозема снижается до 8—10 % (мол.).
При повышении содержания фтористого натрия до 86 % (мол.) растворимость глинозема увеличивается, а затем начинает понижаться. В чистом фтористом натрии глинозем практически не растворяется.
Плотность криолита в твердом виде 2,95 г/см3, алюминия 2,7 г/см3, глинозема 3,9 г/см3. В расплавленном состоянии плотность алюминия примерно на 10 % выше, чем криолито-глиноземного расплава, что вполне достаточно для их разделения.
Плотность криолита и алюминия в расплавленном состоянии зависит от температуры. Этa зависимость определяется по уравнениям:
для алюминия d = 2,382 — 0,000273 (t — 659), для криолита d = 2,112 — 0,00093 (t — 1000),
где t — температура, ºС; d— плотность, г/см3. Добавки к криолиту NaF, АlF3 и Al2O3 снижают плотность расплава.
С повышением температуры плотность криолито-глиноземного расплава, как и чистого криолита, понижается. Для расплава, содержащего 5% Al2O3, при 960 °С она составляет 2,1 г/см3, при этой же температуре плотность алюминия равна 2,3 г/см3.
Плотность алюминия с повышением температуры понижается медленнее, чем плотность криолито-глиноземных расплавов. При понижении температуры плотности криолито-глиноземного расплава и алюминия увеличиваются не в одинаковой степени. Так как у электролита это происходит быстрее, то при снижении температуры может наступить такой момент, когда плотности металла и электролита будут близки и произойдет их перемешивание. При этом металл может всплыть на поверхность, что нарушит процесс электролиза.
Электропроводность криолито-глиноземных расплавов имеет весьма существенное значение в процессе электролиза, так как от величины падения напряжения в слое электролита зависят затраты электроэнергии. Поэтому естественно стремление применять электролит возможно более высокой электропроводности.
Измерения удельной электропроводности расплавленной смеси фторида натрия и алюминия показывают, что наиболее высокой электропроводностью обладает чистый NaF. Удельная электропроводность уменьшается с возрастанием содержания фтористого алюминия, подчиняясь линейной зависимости. Так, удельная электропроводность NaF при 1000 ºС равна 4,46, криолита 2,67, а смеси с 40 % (мол) АlF3 2,01 См */см.
Удельная электропроводность криолито-глиноземного расплава находится в прямой зависимости от содержания глинозема. При изменении содержания глинозема в криолите от 2 до 15 % удельная электропроводность расплава соответственно уменьшается от 2,6 до 1,9 См/см.
В тройной системе Na3AlF6—AlF3—А12O3 удельная электропроводимость равномерно понижается от криолита как в сторону фторида алюминия, так и в сторону глинозема, что связано с уменьшением концентрации ионов Na+, которые переносят практически весь ток в электролите.
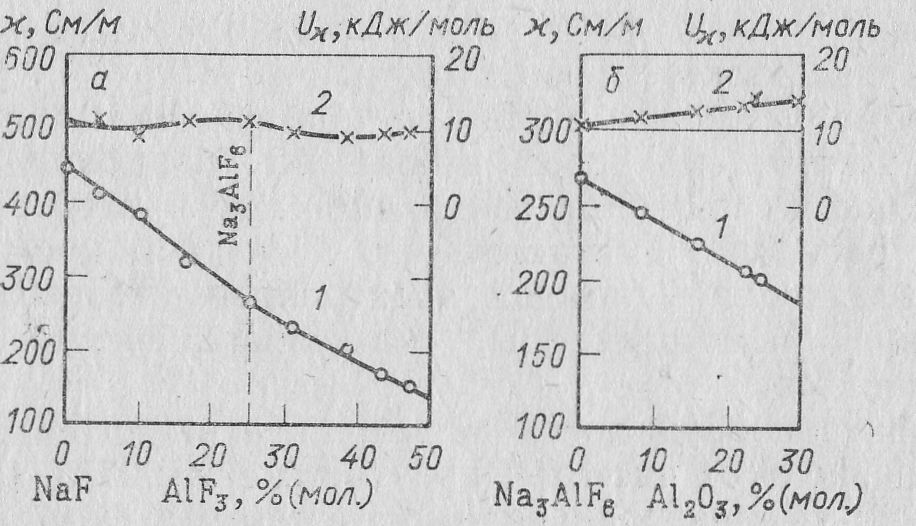
Рис. 12. Удельная электропроводимость расплавов систем NaF—A1F3 (а) и Na3AlF6—А12O3 (б) (Костюков):
1 - изотерма 1000 °С; 2 — энергия активации электропроводимости
Электропроводимость промышленных электролитов отличается от электропроводимости расплавов, синтезированных в лабораторных условиях. Помимо того, что промышленные электролиты содержат, кроме Na3AlF6, AlF3 и Al2O3, еще ряд компонентов, в них всегда имеется взвесь мелких частиц угольной «пены», представляющей собой частицы углерода, попавшие в электролит в результате неполного окисления анода. Несмотря на то, что уголь имеет электропроводимость на три порядка выше, чем электролит, наличие угольных частиц приводит к уменьшению электропроводимости. Происходит это потому, что электролит — проводник второго рода (ионный), а уголь — первого рода (электронный). Если ток протекает через границу их раздела, на поверхности возникает скачок потенциала. На стороне частицы, обращенной к аноду, возникает отрицательный скачок потенциала на стороне, обращенной к катоду,— положительный. Их разность значительно превосходит падение напряжения по длине частицы в электролите, и постоянный ток через частицу не протекает. Чем мельче частицы угольной «пены», тем устойчивее взвесь их в электролите и больше эффект понижения электропроводимости.
Кроме угольных частиц, в промышленных электролитах могут быть взвеси глинозема и карбида алюминия. Они не проводят ток и снижают электропроводимость расплава. Считается, что в среднем промышленные электролиты имеют электропроводимость на 5% меньшую, чем расплавы, синтезированные из чистых компонентов.
При практических расчетах пользуются обратной величиной—удельным электросопротивлением (ρ, Ξμ.см). Для расплава с 2% Al2O3 при 1000 °С удельное электросопротивление будет равно:
ρ= 1/α == 1/2,6=0,385, γде α .— удельная электропроводность, См/см.
* См—симменс (СИ)==1/Ом.
Электропроводность алюминия зависит от содержания в нем примесей. Так, электропроводность алюминия марки А995 составляет 65,45 % от электропроводности меди, а марка А0 62,5 %.
Удельное электросопротивление жидкого алюминия при температурах 950—1000°С равно 3.10-5 Ом.см, что составляет в 15000 раз меньшую величину, чем удельное электросопротивление промышленного электролиза.
Перенос ионов
Числом переноса иона называется доля его участия в переносе тока. Для одно-одновалентных солей числа переноса даются выражениями:
tк= uк/(uк + ua); tА= uА/(uк + uА),
где tк— число переноса катиона, доли ед.; tA — то же, аниона, доли, ед.; uk— скорость движения катиона в электрическом поле, м/с; uА—то же, аниона, м/с.
Среди разнообразных методов определения чисел переноса для криолито-глииоземных расплавов наибольшее применение нашел метод радиоактивных индикаторов, согласно которому, католит и анолит разделены пористой диафрагмой. В одно из этих пространств вводят радиоактивный изотоп и по интенсивности радиоактивного излучения во втором пространстве после пропускания определенного количества электричества судят о числах переноса. Таким способом для расплава фторида натрия было найдено (Гротгейм) число переноса tNa+=0,64 и соответственно tF- = 0,36.
Для криолито-глиноземных расплавов было показано (Франк и Фостер), что перенос тока осуществляется ионами, натрия: tNa+ = 0,99; только 1% тока переносится от катода к аноду анионами, причем отношение количества ионов фтора к количеству кислорода в этих расплавах равно 2.
Вязкость оказывает существенное влияние на процесс электролиза, так как от нее зависят скорость диффузии компонентов электролита, полнота отделения от него металла, удаление анодных газов и другие процессы. Исследованиями вязкости расплавленных смесей фтористого натрия и фтористого алюминия установлено, что в этих смесях максимум вязкости отвечает криолиту (2,75.10-3 Пa.c при 1000°С). При добавлении к криолиту фтористого алюминия снижается вязкость расплава; с повышением температуры расплава вязкость также понижается.
Наибольшее влияние на вязкость криолита оказывают глинозем: при добавлении к криолиту 10% (по массе) Al2O3 вязкость криолитоглиноземного расплава увеличивается на 23 % по сравнению с вязкостью расплавленного криолита при 1000°С. Повышение вязкости криолито-глиноземного расплава по мере увеличения концентрации в нем глинозема объясняется Л. П. Беляевым повышением в расплаве концентрации громоздких комплексных
ионов тина А1О2- и A1O+. Эти ионы увеличивают внутреннее трение, а следовательно, и вязкость расплава.
Вязкость алюминия (99,998% А1) при 950 °С 0,082 Па. с. С понижением температуры вязкость алюминия возрастает и при 660°С составляет 0,118 Па. с.
Поверхностное натяжение — это избыток свободной энергии в поверхностном слое жидкости на границе раздела двух фаз, отнесенный к единице площади поверхности. Если поверхностное натяжение измерять как силу натяжения, действующую на единицу длины (нормальной к направлению силы) вдоль поверхности, то результаты измерения выражают в ньютонах на метр (или на сантиметр).
При электролизе криолито-глиноземных расплавов представляет интерес поверхностное натяжение на границах: расплав—газ, металл—газ, расплав—металл, а также смачиваемость твердых углеродистых материалов криолито-глиноземным расплавом и металлом.
Наибольшим поверхностным натяжением на границе с газовой фазой в системе NaF—АlF3 обладает NaF—1998 мкН/см при 1000 °С. С повышением содержания А1Рз поверхностное патяженнс системы понижается, и для криолита оно составляет 1455 мкН/см, а для смеси с 50% (мол.) АlF3 - 863 мкН/см. Поверхностное натяжение этой системы на границе с газовой фазой практически не зависит от содержания глинозема. Поверхностное натяжение металлического алюминия при 1000 °С более чем в три раза выше, чем криолита.
По данным А. Д. Герасимова и А. И. Беляева, поверхностное натяжение на границе жидкий алюминий —расплав в системе NaF—АlF3 с повышением содержания АlF3 увеличивайся. Если для криолита оно составляет 5200 мкН/см, тo при содержании 33% (мол.) АlF3 -5800 мкН/см, а при 40 % (мол.) АlF3—6400 мкН/см.
Поверхностное натяжение на границе с твердой поверхностью характеризуется краевым углом смачивания (рис. 99). Краевые углы меньше 90° характеризуют низкое, а больше 90°—высокое поверхностное натяжение. В системе NaF—АlF3 на границе расплав—твердая углеродистая поверхность—фтористый натрий имеет наименьший краевой угол смачивания. Под влиянием АlF3 краевой угол смачивания возрастает и достает максимальной величины у криолита. Дальнейшее увеличение содержания АlF3
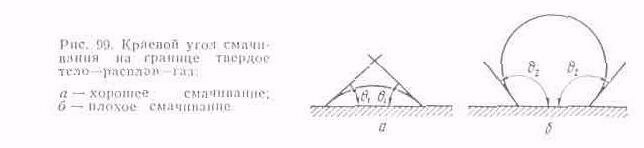
практически не изменяет угол смачивания. Это показывает, что фтористый натрий (катион Na+) в системе NaF—АlF3 является поверхностноактивным веществом. Этим, в частности, объясняется хорошо известная из практики избирательная способность угольной футеровки поглощать из расплава фтористый натрий.
Растворенный в криолите глинозем уменьшает краевой угол смачивания на границе с твердой углеродистой поверхностью.
По данным Л. И. Беляева, уменьшение содержания глинозема в криолите с 15 до 5% (по массе) при 1000°С увеличивает краевой угол смачивания соответственно с 90 до 125°. Дальнейшее уменьшение содержания глинозема приводит к незначительному изменению краевого угла смачивания. В системе криолит—глинозем поверхностно-активным веществом на границе с твердой углеродистой поверхностью является глинозем (анион О2-).
В системе твердая углеродистая поверхность—электролиз—металл смачивающей жидкостью является элекролит. Проникая под металл, электролит пропитывает угольную футеровку электролизера. В криолито-глиноземных расплавах наиболее поверхностно-активными компонентами на границе раздела электролит—углеродистый материал являются KF, NaF и Al2O3.
Давление насыщенного пара компонентов системы NaF и АlF3 возрастает с увеличением содержания фтoристого алюминия, насыщенный пар которого обладает наибольшим давлением. При повышении концентрации АlF3 сверх его содержания в криолите наблюдается резкое повышение давления насыщенного napа, а чем оно выше, тем выше летучесть вещества.
Преимущественное улетучивание при электролизе фтористого алюминия приводит к потерям его и к изменению состава электролита. С повышением температуры летучесть расплава и, следовательно, его потери увеличиваются.
При увеличении содержания глинозема в системе криолит - глинозем давление насыщенных паров всех компонентов системы понижается. При 1000°С и содержании 15 % (по массе) Al2O3 н криолите сумма давлении паров всех компонентов этой системы составляет 482,5 Па (3,62 мм pт. ст.), что в 2 paзa ниже давления пара криолита.
Высокое давление насыщенных паров фторидов натрия и алюминия приводит к потере этих компонентов в процессе электролиза вследствие испарения. Давление насыщенною пара алюминия при температуpax процесса электролиза (950—970 °С) незначительно, следовательно, испарения алюминия, находящеюся под слоем электролит, практически не происходит.
Строение криолито-глиноземных расплавов
Термин «строение вещества» обычно включает в себя три взаимосвязанных понятия: из каких материальных частиц состоит вещество, как эти частицы расположены в пространстве и какова природа сил, их связывающих. Известно, что расплавленные соли при температурах, близких к температуре плавления, наследуют структуру кристаллических солей. Поэтому сведения, имеющиеся о строении твердых солей и их смесей, могут быть в известной мере перенесены на структуру расплавов. Вместе с тем необходимо отметить, что при плавлении сохраняется лишь ближний порядок в расположении частиц, в то время как дальний порядок (т. е. упорядоченность в расположении частиц по всему объему кристаллической решетки, характерная для твердых солей) полностью нарушается.
Более высокая подвижность частиц жидкости, чем кристаллической соли, обеспечивается наличием микрополостей — слившихся между собой нескольких вакансий, которые как бы разъединяют отдельные структурные элементы жидкости.
Расплавы системы NaF—AIF3
Наибольший интерес в этой системе представляет криолит. В твердом состоянии при температуре до 565 °С он имеет моноклинную решетку; несколько искаженные октаэдры A1F63- образуют объемно центрированную элементарную ячейку (рис. 13). В октаэдрах соотношение радиусов ионов таково, что в плотнейшей упаковке ионов F- вписываются ионы А13+. Ионы Na+ занимают два положения: одна треть из них — Na+ (1) находится
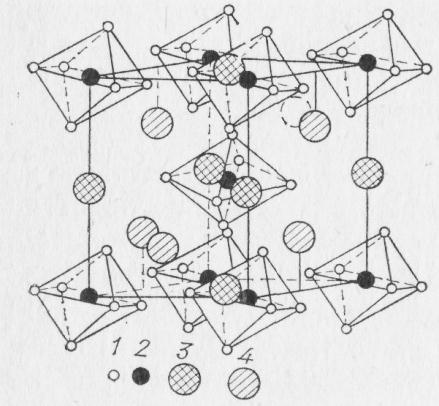
Рис. 13. Кристаллическая решетка криолита:
1 — F-; 2 — А13+; 3 — Na+ (1); 4 — Na+ (2)
на середине ребер элементарной ячейки. Эти ионы имеют шестикратную координацию по отношению к ионам F- и расстояние между ними 0,221 нм. Две трети других ионов — Na+ (2) находятся внутри элементарной ячейки и окружены 12 ионами F- с расстоянием в 0,268 нм. При температуре 565 °С решетка криолита переходит в кубическую. При этом, как установлено рентгеноструктурным анализом (Ландон и Уббелоде), расстояние Na+ (1) — F- уменьшается до 0,219 нм, а расстояние Na+ (2) — F- существенно увеличивается— до 0,282 нм.
Зависимости электропроводимости кристаллических NaF и Na3AlF6 от температуры отличаются характерной особенностью: электропроводимость криолита оказывается на 1—2 порядка выше, чем для кристаллического NaF; при 565 °С, когда происходит полиморфное превращение и увеличиваются расстояния Na+ (2) — F-, на политерме электропроводимости криолита имеется скачок.
Сопоставление этих данных показывает, что структура криолита в твердом Состоянии характеризуется высокой степенью разупорядоченности: ионы Na+ (2), особенно при температуре выше 565 °С, обладают большой подвижностью и передвигаются в междуузлиях решетки, обеспечивая высокую электропроводимость криолита. Происходит «плавление» катионной решетки криолита. Вместе с тем ионы Na+ (2), находящиеся в междуузлиях, вырывают по, одному иону F- из комплексов AlF63-, т. е. еще до температуры плавления криолита, в твердом состоянии происходит термическая диссоциация криолитовых комплексов:
A1F63- =A1F4-+ 2F-. (11)
При переходе через точку плавления эта диссоциация усиливается в еще большей степени, однако определенная концентрация криолитовых комплексов остается в расплаве, что и определяет наличие максимумов на диаграммах плотности и вязкости (см. рис. 4 и 11).
Хиолит 5NaF*3AlF3 в твердом состоянии имеет слоистую решетку, образованную октаэдрами A1F63-. При плавлении происходит распад этого соединения (инконгруэнтное плавление). Рентгеноструктурные исследования возгонов показали, что над расплавом хиолита пар состоит из криолита и тетрафторалюмината натрия. Это означает, что и в расплаве существуют группировки, отвечающие этим соединениям, т. е. комплексные ионы A1F63- и A1F4-, причем доля последних возрастает по мере роста концентрации A1F3.
Тетрафторалюминат натрия NaAlF4 имеет кристаллическую решетку, в узлах которой находятся ионы Na+ и октаэдры AlF63+. Однако в отличие от криолита эти октаэдры сильно искажены: при удвоенной сумме радиусов ионов алюминия и фтора, равной 0,380 нм, постоянная решетки равно 0,348 нм, что указывает на сильную взаимную поляризацию ионов алюминия и фтора. Силы связи между этими ионами в значительной степени имеют ковалентный характер.
Рентгеноструктурный анализ закаленных проб, отвечающих по составу эквимольной смеси NaF и AlF3, указывает на наличие соединения NaAlF4. При медленном охлаждении происходит распад его на AIF3 и 5NaF*3AlF3. Таким образом, в жидком состоянии NaAlF4 довольно устойчив, что подтверждается и тем обстоятельством, что эти смеси являются азеотропными, т. е. в равновесии состав жидкости и пара одинаков.
Таким образом, расплавы системы NaF—AlF3 состоят из ионов: Na+, F-, AlF63- и A1F4- Комплексные ионы A1F63- и AlF4- имеют динамическую природу: возникая в одном месте, они распадаются в другом, и их следует рассматривать как временные упорядоченности ионов F- вокруг А13+.
Расплавы системы Na3AlF6—Al203
В узлах кристаллической решетки ά-глинозема находятся ионы А13+, вокруг которых группируются ионы О2- в шестикратной координации, в то время как координация ионов А13+ вокруг O2- тетраэдрическая, что обеспечивает стехиометрическое соотношение между ними. В отличие от солей в кристаллах оксидов значительна доля ковалентных связей, что накладывает определенный отпечаток на строение, в частности, растворов глинозема в криолите.
Прежде всего, возникает вопрос: почему криолит растворяет оксиды, в то время как в других расплавленных солях оксиды металлов практически не растворяются? Предполагается (Пазухин), что растворение глинозема в криолите связано с обменом ионами F- и О2- между анионами А1F63- расплавленного криолита и решеткой глинозема. Катионы А13+, принадлежащие криолиту, вырывают своим сильным полем анионы О2- из решетки глинозема. В результате этого обмена целостность кристаллической решетки глинозема нарушается и глинозем растворяется. Радиусы ионов F- (0,133 нм) и О2- (0,132 нм) близки между собой, что облегчает замену F- на О2-.
Таким образом, «растворителем» глинозема (и других оксидов) в криолите является ион А13+, входящий в криолитовые комплексы A1F63- и AIF4-.
В результате обмена F- на О2- в окружении ионов А13+ происходит образование новых оксифторидных комплексов типа AlOFx1-x, где x=2÷5. Простейший из таких комплексов A1OF2-; образование его можно представить реакцией:
Na3AlF6+ Al2O3=3NaA1OF2. (12)
Криоскопические исследования разбавленных растворов глинозема в криолите (Ролен, Холм) показывают, что понижение точки замерзания криолита при внесении в него глинозема соответствует случаю, когда растворенное вещество вносит в растворитель три «новые» частицы. Действительно, по реакции (12) на каждую молекулу глинозема образуется три новых оксифторидных иона AlOF2-.
Рассмотренные выше термодинамические характеристики глинозема, растворенного в криолите, также указывают, что растворение сопровождается заметным взаимодействием криолита и глинозема. Вместе с тем на диаграммах состав — свойство системы Na3AlF6 —А12O3 (см. рис.4, 6, 11, 12) не имеется никаких доказательств этого взаимодействия: диаграмма плавкости представляет собой простую эвтектическую систему, а на других диаграммах имеется монотонный ход изотерм. Объяснение этого состоит в том, что оксифторидные комплексы не имеют строго определенного состава: по мере роста концентрации растворенного глинозема строение оксифторидных комплексов усложняется, соотношение количеств ионов фтора и кислорода в них понижается. При больших концентрациях А12O3 в заэвтектической области, по-видимому, образуются сетки из алюминий-кислородных ионов с включенными в них ионами фтора. Вязкость таких расплавов резко увеличивается.
При равновесной кристаллизации происходит разрушение комплексов, и криолит кристаллизуется отдельно от глинозема. При закалке образуется твердый раствор глинозема в криолите.
Таким образом, глинозем, вводимый в криолитовый расплав, вступает во взаимодействие с криолитовыми комплексами и образует оксифторидные комплексы переменного состава. Расплав состоит из ионов: Na+, A1F63-, AlF4-, F-, AlOFx1-x.
 2015-08-12
2015-08-12 5975
5975








