Промышленный электролит обладает всеми свойствами криолито-глиноземного расплава как основной его части (рис. 100).
Вместе с тем в cocтaвa промышленного электролита, кроме криолито-глиноземного расплава, несколько обогащенного фтористым алюминием, входят различные добавки и примеси, поступающие с сырьем, которые в значительной мере изменяют свойства электролита.
Ранее упоминалось, что в состав промышленною электролита вместе с сырьем покупают CaF2 и оксиды различных химических соединений, а также частицы углеродистых материалов. Кроме того, для улучшения некоторых свойств криолито-глиноземного расплава в промышленный электролит вводят в виде добавок LiF, MgF2 и NaCl. В результате взаимодействия всех этих составляющих свойства промышленного электролита значительно отличаются от свойств криолито-глиноземного расплава
Наиболее детально свойства промышленных электролитов исследованы А. И. Беляевым, А. А. Костюковым, М. М Витюковым.
Измерением плавкости, плотности, вязкости и электропроводности установлена количественная разница между этими свойствами образцов промышленного электролита и свойствами соответствующих расплавов системы Na3AlF6— АlF3—Al2O3 при 1000 °С.
В процессе электролиза содержание примесей относительно постоянно —изменяется во времени на незначительную величину, как и содержание добавок к электролиту. Переменными величинами, от которых зависят свойства электролита при оптимальном режиме, являются концентрация глинозема и криолитовое отношение. При применении непрерывного питания электролизеров глиноземом концентрацию его в электролите можно принять постоянной. В этом случае влияние глинозема на свойства электро лита будет практически одинаковым для электролита с различным криолитовым отношением.
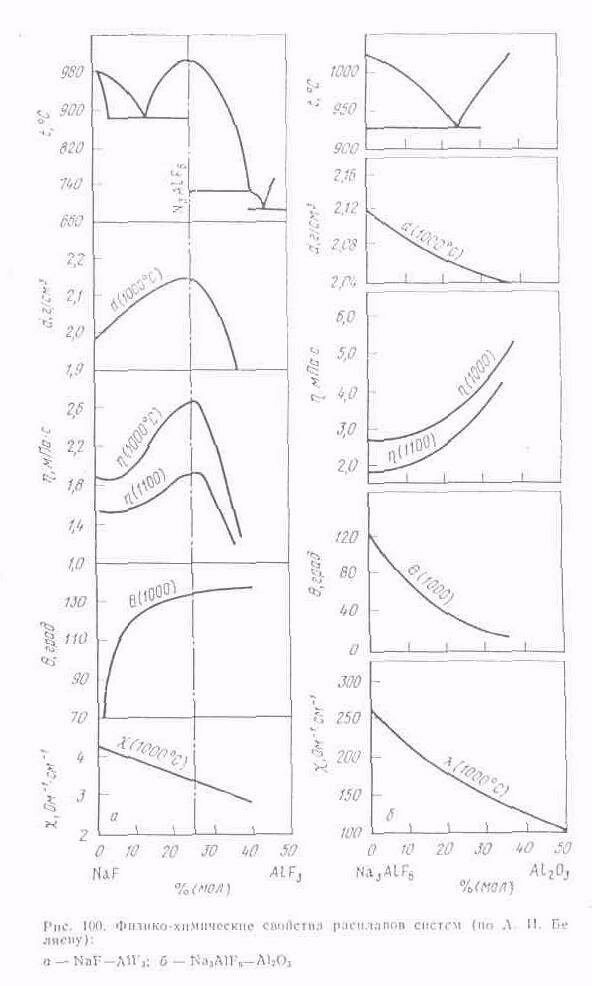
Промышленный электролит, содержащий 5% (по массе) Al2O3 и 4 % (по массе) CaF2, в зависимости от изменения криолитового отношения от 2,1 до 2,7 обладает соответственно следующими свойствами: температура начала кристаллизации 935—960°С;
плотность 2,09—2,11 г/см3; вязкость 0,295—0,325 Па.с; удельная электропроводность 1,85—2,05 См/см. Если учесть, что перегрев электролита, необходимый для нормального протекания процесса, составляет 15°С, то рабочая температура электролита такого состава должна быть 950—975 °С.
В табл. 9 приведены полученные А. И. Беляевым значения некоторых физико-химических свойств промышленною электролита,
содержащею 4—6% (по массе) CaF2, в зависимости от содержания в нем глинозема и от криолитового отношения (К. О.).
Т а б л и ц а 9. Свойства промышленного электролита с 4—6% (по массе) CaF2
| Al2O3, % (по массе) | |||
| К. О. | 1.3-2 | ||
| Температура начала кристаллизации, ºС | |||
| 2,8—2,6 | 945—940 | 960—955 | 975—970 |
| 2,6—2,4 | 910—935 | 955—950 | 970—965 |
| 2,4—2,3 | 935- 930 | 950—945 | 965—960 |
| 2,3—2,2 | 930—920 | 945—935 | 960—950 |
| 2,2—2,1 | 920—910 | 935—925 | 950—940 |
| Плотность,* г/см3 | |||
| 2,7—2,4 | 2,105—2,085 | 2,110—2,090 | 2,125—2,105 |
| 2,4-2,1 | 2.085-2.050 | 2,090—2,065 | 2,105—2,075. |
| Вязкость *η•10-3, Па.с | |||
| 2,7—2,5 | 3,65-3,50 | 3,25—3,10 | 2,95 - 2,80 |
| 2,5—2,3 | 3,50—3,35 | 3,10—2,95 | 2,80—2,65 |
| 2,3—2,1 | 3,35—3,20 | 2,95—2,80 | 2,65—2,50 |
| Удельная электропроводность,* См/см | |||
| 2,7—2,5 | 1,85—1,75 | 2,05—1,95 | 2,25 – 2,15 |
| 2,5—2,3 | 1,75—1,65 | 1,95—1,85 | 2,15—2,05 |
| 2,3—2,1 | 1,65—1,55 | 1,85—1,75 | 2,05—1,95 |
| * При рабочей температуре электролиза. |
Более низкая электропроводность и повышенная вязкость промышленного электролита по сравнению с криолито-глиноземным расплавом соответствующего состава объясняется отрицательным влиянием примесей, поступающих с сырьем, и углеродистых частичек, всегда присутствующих в промышленном электролите. При содержании в электролите 0,5% (по массе) углерода снижается его электропроводное и, на 6—7% Обычно при нормальной работе в электролите содержится 0,05- 0,1 % (по массе) углерода.
Введение различных добавок в промышленные электролиты необходимо для снижения температуры ею плавления и улучшения других его физико-химических свойств Наиболее часто применяемые добавки CaF2, LiF, MgF2 и NaCl. Все эти добавки в большей степени, чем АlF3, снижают температуру плавления электролита, а это позволяет работать с криолитовым отношением 2,7-2,9, при котором значительно уменьшается летучесть компонентов электролита и повышается его электропроводность.
Наибольшее снижение температуры плавления электролитa (на 50-55 ºС) достигается добавлением LiF; NaCl снижает температуру плавления па 30-35°С, остальные добавки—на 20—25 °С.
Отрицательным свойством всех добавок является значительное уменьшение растворимости глинозема в электролите, что осложняет обслуживание электролизеров. Для создания приемлемых условии работы содержание отдельных компонентов или суммы добавок в промышленном электролите не должно превышать 10 % (по массе), что соответствует максимальной растворимости глинозема 8—10% (по массе). При введении добавок следует учитывать также, что в их присутствии скорость растворения глинозема в электролите уменьшается.
Присутствие в электролите NaCl снижает межфазное натяжение расплава на границе с углеродистой поверхностью.
Влияние солевых добавок
Помимо основных компонентов электролита — криолита, фтористого алюминия и глинозема, в расплав специально вводят другие соли. Эти добавки изменяют физико-химические свойства электролита и приводят к улучшению показателей процесса электролиза.
Прежде чем рассматривать влияние каждой соли, выясним, какой эффект можно вообще ожидать от введения посторонних добавок в электролит.
Применяемые соли должны иметь катионы более электроотрицательные, чем А13+, а анионы более электроположительные, чем О2-. В противном случае будет происходить восстановление катионов добавок на катоде с загрязнением алюминия и окисление анионов на аноде с получением нежелательных продуктов в анодных газах. Другими словами, добавки должны быть в электрохимическом отношении индифферентными.
Первое, что ожидается от введения добавки — понижение температуры ликвидуса электролита. Действительно, введение другой соли дает более сложные системы, обычно эвтектического типа, что и приводит к понижению температуры начала кристаллизации. Необходимо, однако, иметь в виду, что понижение температуры плавления электролита не может автоматически привести к снижению рабочей температуры электролиза (со всеми вытекающими отсюда благоприятными последствиями).
Работающий электролизер находится в энергетическом равновесии с окружающей средой: сколько энергии выделяется внутри электролизера, столько расходуется на осуществление реакции и на компенсацию потерь энергии в окружающее пространство. Если в результате введения добавки произошло понижение температуры плавления электролита, то температура электролиза может снизиться только в том случае, если повысятся потери энергии в окружающее пространство. Опыт показывает, что обычно так и происходит: понижение температуры плавления приводит к уменьшению толщины гарниссажей из застывшего электролита на боковой поверхности футеровки, а также толщины корки электролита сверху ванны, отчего увеличиваются потери энергии.
Нарушенное энергетическое равновесие электролизера за счет введения добавок может быть восстановлено путем повышения плотности тока, что приводит к увеличению выделений энергии внутри электролизера до тех пор, пока не будут скомпенсированы увеличенные потери энергии. Этот путь приводит к повышению производительности электролизеров. —
Из других физико-химических свойств электролита, изменяющихся при введении добавок, отметим прежде всего электропроводимость. Повышение ее приводит при прочих равных условиях к увеличению производительности электролизеров либо за счет увеличения плотности тока при неизменном междуполюсном расстоянии, либо за счет повышения выхода по току, вызванного увеличением междуполюсного расстояния. Первый путь более эффективен.
Понижение вязкости электролита желательно для увеличения циркуляции и улучшения теплообмена и переноса растворенного глинозема между периферией и центром электролизера. С другой стороны, усиление циркуляции электролита приводит к повышению потерь металла.
Повышение плотности электролита нежелательно, поскольку уменьшается разность плотностей между электролитом и металлом, что способствует перекосу поверхности металла и увеличению высоты волн на этой поверхности. Большинство добавляемых солей имеют давление насыщенного пара значительно ниже, чем основные составляющие электролита — криолит и фтористый алюминий, что способствует снижению общего давления пара и уменьшению потерь солей с возгонами.
Добавляемые соли уменьшают активность NaF и AlF3, вследствие чего взаимодействие алюминия с электролитом ослабляется и потери металла по реакциям (25) и (26) уменьшаются, а выход по току повышается. Вместе с тем разбавление электролита индифферентной солью приводит к уменьшению активности комплексов A1F63- которые являются «растворителями» глинозема. Поэтому солевые добавки понижают растворимость глинозема, что вызывает ряд технологических затруднений: рост осадков и настылей на подине электролизеров, нарушение нормального питания глиноземом. Только введение в электролит фторидов калия могло бы привести к повышению растворимости глинозема, но соли калия никогда не вводят по той причине, что калий, восстанавливаясь на катоде, проникает в угольную футеровку и легко ее разрушает.
При выборе добавок большое внимание обращают на стоимость и доступность соли, а также на ее физические свойства, такие как гигроскопичность, склонность к гидролизу, токсичность.
В табл. 4 приведены физико-химические свойства криолитовых расплавов с добавками 10% (по массе) различных солей.
Таблица 4. Физико-химические свойства расплавленного криолита с добавками 10% (по массе) солей при 1000 °С
| Соль | Понижение температуры плавления, °С | Плотность, г/см3 | Удельная электропроводимость, См/м | Вязкость, мПа*с | Потери алюминия на 100 г расплава, г/ч |
| Без добавок | - | 2,100 | 2,75 | 1,20 | |
| LiF | 2,060 | 1,63 | 1,20 | ||
| MgF2 | 2,106 | Нет св. | 0,75 | ||
| CaF2 | 2,162 | 2,88 | 0,95 | ||
| NaCl | 2,010 | 2,40 | 1,30 | ||
| MgCl2 | 2,020 | 1,50 | 1,05 |
Рассмотрим теперь более подробно влияние каждой из добавляемой соли на процесс электролиза.
Фторид кальция — обычно специально в электролит не вводят, поскольку эта соль присутствует как примесь в криолите и фториде алюминия. Диаграмма плавкости системы Na3AlF6—CaF2 эвтектического типа, с температурой эвтектики 945 °С при 50% (мол.) CaF2 (Холм). Фторид кальция понижает температуру плавления меньше, чем другие солевые добавки. Он повышает плотность и вязкость и понижает электропроводимость, что нежелательно. Фтористый кальций способствует созданию устойчивых гарниссажей и настылей и повышает выход по току.
Фторид магния—по многим свойствам более эффективная добавка, чем фторид кальция. Понижает температуру плавления значительно больше, чем другие добавки. В системе NaF—MgF2 имеется химическое соединение NaMgF3 (Костюков, Смородинов), поэтому система Na3AlF6—MgF2 является нестабильным диагональным сечением взаимной тройной системы: Na3AlF6 + 3MgF2 ↔ AlF3 + 3NaMgF3.
По некоторым данным, в системе NaF—MgF2 имеется еще одно соединение — Na2MgAlF7, что в значительной степени усложняет диаграмму состояния.
Добавка фтористого магния ухудшает смачивание расплавом угольных частиц и способствует полному отделению угольной «пены». Обычно в электролит вводят оксид магния, при этом фторид магния получается в результате реакции обмена
3MgO + 2Na3AlF6 =3MgF2 + Al2O3 + 6NaF.
Суммарное содержание фторидов кальция и магния обычно не превышает 6—8% (по массе).
Фторид лития — при взаимодействии с натриевым криолитом образует литиевый криолит Na3AlF6 + 3LiF↔Li3AlF6+3NaF, температура плавления которого 800 °С. В литиевом криолите растворимость глинозема приблизительно в 4 раза меньше, чем в натриевом. Поэтому добавки LiF в электролит приводят к резкому снижению растворимости Al2O3. Главное свойство добавок литиевых солей — сильное увеличение- электропроводимости электролита, что связано с малым, по сравнению с ионом Na+ радиусом иона Li+_ Поэтому добавки солей лития позволяют значительно' интенсифицировать процесс электролиза. Основное препятствие для использования солей лития в качестве добавок — высокая их стоимость и дефицитность.
Хлорид натрия увеличивает электропроводимость, электролита и существенно снижает температуру плавления. Реакция обменного разложения 3NaCl + Na3AlF6=6NaF+AlCl3 практически не происходит, поскольку для нее ΔG°= + 318 кДж/моль криолита. Испытания добавок хлорида натрия показали, что происходят потери ионов С1- из электролита, что связано с испарением NaCl. Взаимодействие этих паров с медными анодными спусками (в электролизерах БТ) приводит к значительной их коррозии. Другой существенный недостаток добавки NaCl — упрочнение электролитной корки, по-видимому, вследствие поглощения паров NaCl. Вместе с тем, как указано выше, добавки иона С1- в электролит приводят к заметному снижению расхода углерода. Для нивелирования упомянутых недостатков добавки NaCl эту соль вводят в электролит только в комбинации с другими добавками.
Хлорид магния существенно понижает температуру плавления и вязкость электролита. Однако применение его затруднено из-за склонности соли к гидролизу, при котором вместе с добавкой MgCl2 вносится в электролит значительное количество влаги, что недопустимо с позиций техники безопасности.
На некоторых заводах применяют совместные добавки NaCl и MgF2, при этом происходит повышение электропроводимости электролита за счет введения катионов Na+ и заметное снижение расхода углерода, поскольку вносятся анионы С1-, в то же время не наблюдаются недостатки, свойственные добавке одного NaCl.
Поведение примесей
Влияние примесей на процесс электролиза сводится, с одной стороны, к загрязнению алюминия элементами, •существенно ухудшающими его свойства, с другой — к изменению физико-химических свойств электролита, которые приводят к нарушению нормального течения электролиза. Основными источниками примесей являются исходные материалы: глинозем, фтористые соли и анодная масса (аноды). Кроме того, примеси поступают из футеровки и стального инструмента. Обычно настыли и гарниссаж, образующиеся в начальный период работы после пуска, имеют повышенное содержание примесей, поэтому нарушение работы электролизеров, связанное с расплавлением настылей и гарниссажа, также приводит к повышению содержания примесей в металле.
Влага поступает в электролит с глиноземом и фтористыми солями. Она содержится в глиноземе в двух формах: гигроскопической, удаляющейся при прокаливании на корке электролита, и связанной — в виде гидратов, которая удаляется труднее и отчасти переходит в электролит.
Фторид алюминия, содержащийся в электролите, при высоких температурах подвергается гидролизу 2/3AlF3+H2O↔1/3Al2O3+2HF при этом фтористый водород удаляется вместе с анодными газами. Константа равновесия этой реакции (Машовец и Юдин)
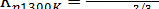 (52)
(52)
Для чистого фторида алюминия, в котором глинозем практически не растворяется (a Al2O3=l) равновесные давления будут ρHF = 95,32 кПа и ρH2O = 5,97 кПа, т. е. фторид алюминия почти нацело гидролизуется. Если принимать указанные выше значения активностей аAlF3 (см. рис. 8) и глинозема (см. рис. 10), то для электролита промышленных ванн (К.О. = 2,7 и концентрация глинозема 5% по массе) соответствующий расчет дает равновесные давления: ρHF = 38,0 кПа и ρH2O= 63,0 кПа. Эти величины давлений получены при условии, когда ρHF + ρH2O = 101,3 кПа.
Глинозем, поступающий в электролит, обычно прокаливается на корке, и основная масса воды удаляется, поэтому потери фторида алюминия относительно невелики: если считать, что в глиноземе останется 0,1% (по массе) воды, то на 1 т алюминия за счет реакции гидролиза будет затрачиваться всего 1,8 кг фтористого алюминия.
Источниками влаги являются также водород и углеводороды, образующиеся при коксовании анодной массы. Вода образуется по реакции Н2 + СO2 = Н2O + СO. Если допустить, что вся эта влага реагирует с фтористым алюминием, то потери его составят уже 19 кг на 1 т алюминия. На самом деле часть воды растворяется, в электролите и подвергается электролитическому разложению с выделением на катоде водорода, который растворяется в алюминии. При литье алюминиевых слитков водород вследствие понижения его растворимости выделяется в виде пузырьков, и качество отливок ухудшается. Для электролизеров с обожженными анодами этот источник влаги отсутствует.
Оксиды щелочных и щелочно-земельных металлов поступают в электролит в основном с глиноземом. Вредное влияние их на процесс связано прежде всего с изменением состава электролита за счет реакции обмена 2Na3AlF6 + 3Na2O=12NaF + Al2O3. В результате концентрация фторида алюминия падает и криолитовое отношение возрастает. Для корректировки состава электролита приходится вводить дорогой фторид алюминия.
Равновесное содержание натрия в алюминии составляет тысячные доли процента и повышается с возрастанием криолитового отношения и температуры. В промышленных условиях также отмечается, что повышение криолитового отношения с 2,5 до 3 вызывает увеличение содержания натрия от 0,005 до 0,014% (по массе). Между тем при производстве некоторых деформируемых сплавов на основе алюминия примесь натрия в таких концентрациях является недопустимой и приходится принимать специальные меры для его удаления.
Оксиды металлов, более электроположительных, чем алюминий (SiO2, TiO2, Fe2O3, V2O5, Сr2O3 и др.), попадают в электролит из исходных материалов или футеровки электролизеров. В электролите они хорошо растворимы и подвергаются электролитическому разложению, причем на катоде выделяется металл, загрязняющий алюминий. Часть оксидов кремния, титана, ванадия и хрома взаимодействует с криолитом по реакциям типа 3SiO2+4Na3AlF6↔3SiF4+12NaF+2Al2O3.
Хотя термодинамические расчеты показывают, что константы равновесия этих реакций малы (за исключением SiO2), но получающиеся продукты — фториды соответствующих металлов обладают большим давлением пара и уносятся анодными газами. Поэтому такие реакции играют существенную роль в удалении соответствующих примесей из электролита.
На промышленных электролизерах показано (Сенин), что 20—37% соединений ванадия, титана и хрома удаляются через системы газоулавливания.
Примеси титана, ванадия, хрома и марганца сильно снижают электропроводимость алюминия и поэтому особенно нежелательны для металла, идущего на производство проводов. Для очистки алюминия от этих примесей применяется добавка бора. Соединения бора — буру или борную кислоту вводят в электролит, где они разлагаются электролитически, а выделяющийся бор соединяется с указанными металлами, давая интерметаллиды. При этом концентрация примесей металлов в алюминии существенно понижается.
Повышение содержания бора до 0,017% приводит к снижению концентрации ванадия и титана в 5—6 раз (Сенин). Кроме того, введение бора в алюминий и его сплавы способствуют модификации — получению мелкокристаллической структуры, что улучшает пластические свойства металла.
Сульфаты и сульфиды поступают в электролит с глиноземом, фторсолями (сульфаты) и с анодной массой (сульфиды). Сульфаты вступают в обменную реакцию с криолитом 3Na2SO4+2Na3AlF6=Al2(SO4)3+ 12NaF, в результате которой повышается криолитовое отношение электролита. Растворенный в электролите сульфат восстанавливается алюминием 3Na2S04+8Al=3Na2S+ +4Al2O3, а получающийся сульфид переносится к аноду и окисляется: S2--2e = S; S + 2CO2 = SO2 + 2CO. Выделяющийся сернистый газ ухудшает условия труда в цехе.
Наличие заметных количеств серы в анодной массе нежелательно, поскольку на стальных штырях образуется корка плохо проводящего ток сульфида железа FeS, что повышает падение напряжения в аноде.
Фосфорный ангидрид Р2О5 поступает в электролит с глиноземом и фторсолями. Фосфор является вреднейшей примесью в алюминии, так как вызывает его красноломкость. Кроме того, с повышением содержания фосфора до 0,002% (по массе) заметно уменьшается коррозионная стойкость алюминия и сплавов на его основе.
Присутствие соединений фосфора в электролите приводит к улучшению смачивания электролитом угольной «пены». Взвесь углерода плохо отделяется от электролита, электросопротивление его увеличивается, электролизер перегревается и процесс электролиза нарушается.
При электролизе фосфор удаляется главным образом в виде летучих соединений (с газами) и с угольной «пеной». При флотации «пены» фосфор уходит в хвосты и не возвращается в электролит.
ТЕРМОДИНАМИКА ОСНОВНЫХ РЕАКЦИЙ
Общие сведения
Рассмотрим в общем виде реакцию разложения соединения на элементы:
AnXm=nA+mX.
Константа равновесия этой реакции, выраженная через активности компонентов, выражается уравнением:

Она может быть подсчитана из величины изменения энергии Гиббса реакции:
ΔG°= - R*T*ln Ка.
По величине энергии Гиббса можно судить о возможности: протекания реакции в ту или иную сторону. При больших отрицательных значениях ΔG° реакция полностью смещена вправо, при больших положительных — она самопроизвольно не происходит. В тех случаях, когда для участников реакции известны термодинамические данные, может быть подсчитано ΔG° реакции и определена величина константы равновесия.
Если, например, известны следующие характеристики: стандартная энтальпия образования соединений, изменение энтальпии от стандартного состояния до определенной температуры и энтропия всех участников реакции, то изменение энтальпии и энергии Гиббса для реакции может быть подсчитано следующим образом. Изменение энтальпии — по величинам энтальпии компонентов реакции, причем для соединений принимается также энтальпия образования их из элементов в стандартном состоянии. Энтальпия реакции получается как алгебраическая сумма энтальпии всех компонентов, причем для продуктов реакции энтальпии принимаются со знаком плюс, для исходных веществ — со знаком минус. Изменение энергии Гиббса — из уравнения Гиббса—Гельмгольца ΔG°=ΔH°—TΔS°, где ΔS° — изменение энтропии участников реакции, Дж/(моль*К). Для подсчета ΔS° суммируются энтропии компонентов реакции, причем для исходных веществ принимаются отрицательные значения, для конечных — положительные.
В табл. 2 приведены термодинамические данные для веществ, имеющих значение при электролитическом получении алюминия, по справочнику В. П. Глушко «Термодинамические свойства индивидуальных веществ» (изд. «Наука» 1981 г.). Используя эти данные, можно рассчитать термодинамические величины для основных реакций, протекающих в алюминиевых электролизерах.
Рассчитаем, например, величины ΔН0 и ΔG° для реакции разложения глинозема на элементы при 1300 К:
А12O3(к) = 2А1 (ж) + 1,5O2(г). (13)
Изменение энтальпии для алюминия 90,08 кДж, для кислорода 63,05 кДж, для глинозема -1537,45 кДж.
Изменение энтальпии для всей реакции ΔH = 1690,58 кДж.
Энтропия для алюминия: 163,92 Дж/(моль*К), для кислорода 379,16 Дж/(моль*К), для глинозема 213,60 Дж/ /(моль*К). Общее изменение энтропии ΔSo=329,48 Дж/ /(моль*К)
Изменение энергии Гиббса для реакции: ΔG°=ΔH°-TΔS° = 1262,26 кДж.
В расчете использованы данные для твердого глинозема. Эти данные могут быть использованы и для насыщенных растворов глинозема в электролите, поскольку химический потенциал глинозема в насыщенном растворе равен таковому для твердого глинозема. Состояние глинозема в насыщенном растворе будем принимать за стандартное, поэтому все величины для него имеют индекс ° (ΔН° и ΔG°).
Таблица 2. Термодинамические данные для веществ, имеющих значение при электролитическом получении алюминия
| Вещество | ΔH°обр(0) кДж/моль | Температура, К | ||||
| А1(ж) | 35,51 | 38,69 | 41,86 | 45,04 | 48.21 | |
| 73,63 | 76,66 | 79,42 | 81,96 | 84,32 | ||
| С(кр.графит) | 12,79 | 14,99 | 17,26 | 19,59 | 21,96 | |
| 24,45 | 26,55 | 28,52 | 30,38 | 32,14 | ||
| F2(г) | 33,49 | 37,17 | 40,91 | 44,68 | 48,47 | |
| 244,44 | 247,99 | 251,25 | 254,26 | 257,07 | ||
| Cl2(г) | 34,70 | 38,42 | 42,14 | 45,88 | 49,62 | |
| 266,60 | 270,14 | 273,39 | 276,38 | 279,15 | ||
| Na(ж) | 29,91 | 32,80 | 35,72 | 38,69 | 41,73 | |
| 94,49 | 97,24 | 99,79 | 102,16 | 104,42 | ||
| Na(г) | 20,79 | 22,87 | 24,94 | 27,02 | 29,10 | |
| 178,76 | 180,74 | 182,55 | 184,22 | 158,76 | ||
| О2(г) | 31,39 | 34,90 | 38,45 | 42,03 | 45,65 | |
| 243,47 | 246,82 | 249,90 | 252,77 | 255,45 | ||
| A1C1 (г) | —51,20 | 35,11 | 38,88 | 42,65 | 46,43 | 50,23 |
| 271,99 | 275,58 | 278,86 | 281,89 | 284,70 | ||
| АlС13(г) | —582,30 | 72,10 | 80,29 | 88,51 | 96,73 | 104,97 |
| 408,70 | 416,51 | 423,66 | 430,24 | 436,35 | ||
| AlF(г) | —265,40 | 33,72 | 37,43 | 41,15 | 44,89 | 48,63 |
| 257,26 | 260,80 | 264,04 | 267,03 | 269,81 | ||
| AlF3(к) | —1504,22 | 78,98 | 89,11 | 99,35 | 109,70 | 120,14 |
| 179.51 | 189,18 | 198,09 | 206,36 | 214,10 | ||
| Al4C3(к) | —201,96 | 127.33 | 145,38 | 163,82 | 182,64 | 201,82 |
| 273.33 | 290,53 | 306,57 | 321,63 | 335,85 | ||
| А12О3(к) | —1663,56 | 88,08 | 100,61 | 113,29 | 126,11 | 139,11 |
| 180,36 | 192,30 | 203,33 | 213,60 | 223,23 | ||
| СО2(г) | —393,14 | 42,77 | 48,26 | 53,85 | 59,52 | 65,27 |
| 269,19 | 274,42 | 279,28 | 283,83 | 288,09 | ||
| CO (г) | —113,81 | 30,36 | 33,70 | 37,10 | 40,54 | 44,01 |
| 234,43 | 237,62 | 240,57 | 243,32 | 245,90 | ||
| CF4(r) | —927,23 | 73,19 | 83,15 | 93,23 | 103,42 | 113,69 |
| 361,04 | 370,53 | 379.31 | 387,46 | 395,07 | ||
| NaF(к, ж) | —574,21 | 41,17 | 53,42 | 59,92 | 101,00( | 108,01 |
| (к) | (к) | (к) | (ж) | (ж) | ||
| 116,36 | 122,32 | 127,97 | 160,42 | 165,62 | ||
| NaCl(к, ж) | —410,81 | 50,63 | 85,53 | 92,32 | 99,11 | 105,90 |
| (к) | (ж) | (ж) | (ж) | (ж) | ||
| 139,43 | 172,07 | 177,98 | 183,41 | 188,44 | ||
| Na3AlF6 (к, ж) | —3310,05 | 231,54 | 260,33 | 289,78 | 435,51 | 474,61 |
| (к) | (к) | (к) | (ж) | (ж) | ||
| 557,97 | 585,41 | 611,03 | 725,03 | 754,00 |
Примечания: 1. Числитель — величина ΔНТ°—ΔH0°, кДж/моль, знаменатель — ST°, Дж/(моль*К). 2. В скобках указано состояние вещества: г — газ; ж — жидкость; к — кристаллы
Из величины ΔG0 определяется напряжение разложения А12O3 (т.е. напряжение равновесной электрохимической системы:
Al/Na3AlF6, Al2O3 (нас)/O2
Eрo=ΔGо/(n*F)=2.18 В,
где п — число электронов, участвующих в реакции; F — постоянная Фарадея, 96486 Кл/моль.
Результаты подобных расчетов для веществ, составляющих электролит, представлены ниже:
ΔG°, кДж/ моль 1150,47/416,29
Ер°, В 3,97/4,31
В числителе — для реакции A1F3=A1+1,5F2; в знаменателе — для NaF=Na+0,5F2.
Из приведенных данных следует, что напряжение разложения Al2O3 меньше, чем NaF и A1F3, поэтому при электролизе происходит разложение глинозема. Только в некоторых специфических условиях электролиза, как будет показано в дальнейшем, возможно разложение других компонентов электролита. Кроме того, необходимо учитывать участие углерода анода во всех процессах электролиза.
Разложение глинозема
Анодные газы, выделяющиеся на промышленных электролизерах, содержат как СО, так и СО2. Эти компоненты газов образуются в результате протекания двух реакций разложения глинозема с участием углерода:
А12O3 + 3С = 2А1 + 3СО, EР°=1.109 (14)
А12O3 + 1,5С = 2А1 + 1,5СО2, EР°=1,211 (15)
Термодинамические расчеты для реакций дают величины ΔН0, ΔG° и напряжения разложения, приведенные ниже:
| Температура, К | |||
| ΔН°, кДж/моль | 1352,03 | 1351,32 | 1348,95 |
| 1099,12 | 1098,68 | 1097,23 | |
| ΔG°, кДж/моль | 642,04 | 628,43 | 583,07 |
| 701,14 | 693,39 | 667,58 | |
| EР°, В | 1,109 | 1,085 | 1,007 |
| 1,211 | 1,198 | 1,153 |
Как будет показано ниже первичным газом при электролизе является СО2, не смотря на большее значение энергии разложения. Это объясняется тем, что анодный процесс многостадийный и конечная реакция зависит от механизма окисления углерода на аноде адсорбированными атомами кислорода.
Из этих данных следует, что изменение энтальпии реакции мало зависит от температуры, в то время как изменение энергии Гиббса и напряжение разложения заметно уменьшается с повышением температуры. Разность между ΔН° и ΔG° представляет собой связанную энергию (сумму теплот Пельтье для обоих электродов), которая для обеих реакций составляет значительную, величину.
Для реакции (15) напряжение разложения как функция концентрации глинозема известно из экспериментальных данных (Ветюков и Нгуен Ван Бан) (рис. 14).
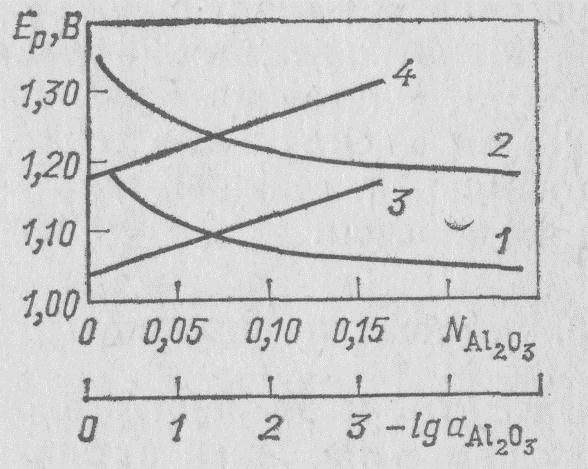
Рис. 14. Зависимость напряжения разложения глинозема от содержания Al2O3 в системе Na3AlF6—Аl2O3 при 1000 °С:
1, 3— для реакции (14); 2, 4 — для реакции (15); 1, 2 — в мольных долях Аl2О3, для 3, 4 — lg aAl2O3
Напряжение разложения глинозема с образованием СО может быть подсчитано с учетом известной величины (ΔG°) энергии Гиббса для реакции
1,5СО2+ 1,5С = 3СО, (16)
равной при 1000°С —82,8 кДж на 1,5 моля СO2, и того, что реакция (14) представляет собой сумму реакций. (15) и (16). Отсюда следует, что напряжение разложения при 1000 °С для реакции (15) будет на 0,135 В выше при любой концентрации глинозема, чем для реакции (14).
Поскольку между напряжением разложения Ер° в стандартном состоянии и Ер при активности компонента, а имеется соотношение:
Ep=Epo-(2.3*R*T/nF)*lga (17)
то в координатах Ep— lga эта зависимость выражается; прямой линией (см. рис. 14).
Так как анодные газы содержат и СO2 и СО, суммарная реакция в электролизе состоит из реакций разложения глинозема (14) и (15). Но от условий электролиза (температуры, состава электролита и др.) зависит, какая реакция превалирует. Поэтому число молей углерода, участвующих в суммарной реакции, будет переменным (обозначим его у). Тогда суммарную реакцию можно представить уравнением:
А12O3+ уС = 2Аl + (3 - у) СO2 + (2у - 3)СО (18)
Коэффициенты при СO2 и СО получены в результате совместного решения двух уравнений. Первое относится к распределению углерода между двумя реакциями 1,5к1+3к2 = у, где к1 и к2 — доли участия реакций (14) и (15) в суммарной реакции. Второе вытекает из условия к1+к2=1.
Из этих уравнений следует: к1=(6-2у)/3; к2= (2у-3) /3. Энтальпия суммарной реакции ΔН°=к1*ΔH1+к2ΔН°2. Остальные термодинамические величины для суммарной реакции могут быть рассчитаны аналогичным образом.
Разложение фторидов
Рассмотрим реакции разложения A1F3 и NaF с учетом участия углерода и активности этих компонентов в расплаве.
Для реакции
4A1F3+3C = 4A1 + 3CF4 (19)
изменение энергии Гиббса при 1300 К составляет ΔG°1300К = 644 кДж/моль AlF3, что отвечает напряжению разложения фтористого алюминия Ер°=2,22 В. Для состава криолита, где активность A1F3 равна 3*10-4 (см. рис. 8), напряжение разложения фтористого алюминия составит 2,52 В. Эта величина соответствует энергии Гиббса для реакции разложения криолита
2Na3AlF6 + 1,5С = 6NaF + 2А1 + 1,5CF4. (20)
Для реакции
4NaF + С = CF4+ 4Na (21)
изменение энергии Гиббса для чистого фторида натрия составляет при 1300 К 253 кДж/моль, что отвечает напряжению разложения Epo = 2,62 В. Для состава криолита напряжение разложения NaF повысится незначительно: Eр = 2,70 В.
Из вышеприведенных данных следует, что напряжение разложения фторида натрия на 0,34 В выше, чем фторида алюминия. Следовательно, потенциал выделения алюминия в стандартном состоянии на 0,34 В положительнее, чем натрия. Однако, как будет показано далее, это не исключает возможности совместного разряда алюминия и натрия.
Различие между напряжением разложения фторида алюминия по реакции (19) и глинозема по реакции (15) еще более значительно и составляет при 1300 К 1,07 В. Но и в данном случае не исключается возможность совместного разряда ионов кислорода и фтора при определенных условиях электролиза. При обычных же условиях электролиза на катоде происходит восстановление ионов алюминия, на аноде — окисление ионов кислорода, причем и те, и другие ионы находятся в расплаве в виде комплексов.
Основные электродные реакции
П. П. Федотьев, создавший теорию электролиза, считал, что первичным является разложение глинозема, причем электродные реакции сводятся к следующему. На катоде: А13++3е=А1, на аноде: 2А1O33--6e=А12O3 +1,5O2.
Выделяющийся кислород взаимодействует с углеродом анода, образуя смесь СО2 и СО.
Эта точка зрения Федотьева в основном принимается и в настоящее время, но с некоторыми коррективами, вытекающими из современных представлений о строении криолито-глиноземных расплавов.
Предположим, что взаимодействие глинозема с криолитом приводит к образованию простейшего типа оксифторидных ионов — A1ОF2- и может быть представлено реакцией
Na3AlF6+ А12O3= 3NaA10F2= 3Na++3AlOF2-.
Как мы уже видели, перенос тока осуществляется почти полностью ионами Na+; разряду подвергаются оксифторидные комплексные ионы.
Катодный процесс можно представить реакцией
3A1ОF2- + 6е = 2А1 + 6F- + АlO33-. (22)
Анодный процесс:
3A1ОF2- - 6е + 1,5С = 1,5СO2 + 3А13++ 6F-. (23)
Суммарно:
2NазА1F6+2А12О3+1,5С = 2А1+1,5СО2+2Nа3А1F6+А12О3
Рассмотрим, какие изменения произойдут в анолите и католите при прохождении 6 фарадеев электричества.
В католите в результате переноса тока накопилось 6 ионов Na+, кроме того от диссоциации 3NaA1OF2 осталось 3 иона Na+. Изменение состава католита сводится к накоплению 6 молей фторида натрия и 1 моля алюмината натрия:
9Na++6F-+AlO33- =6NaF+Na3AlO3.
Из анолита в результате переноса ушло 6 ионов Na+ и осталось 6 ионов A1OF2- Три из них разрядились по реакции (23), три остались в анолите. Вместе с избыточными ионами А13+ и F-, получающимися при разряде, эти оксифторидные ионы дают 4 моля фторида алюминия и 1 моль глинозема:
3A1ОF2-+3A13++6F- =4A1F3 + А12O3.
Таким образом, в результате электролиза католит становится более «щелочным», а анолит — более «кислым». В условиях промышленного электролиза происходит энергичное перемешивание католита и анолита, и состав электролита почти выравнивается:
6NaF + Na3AlO3+ 4A1F3+ А12O3= 3Na3AlF6+2Al2O3. (24)
При пропускании 6 фарадеев электричества в процессе было вовлечено 9 молей NaA1OF2 (3 на катоде и 6 на аноде). Для образования такого количества оксифторидных комплексов понадобилось 3 моля глинозема. В результате всех процессов осталось 2 моля глинозема, один разложился при электролизе.
3NазА1F6+3А12О3+1,5С = 2А1+1,5СО2+3Nа3А1F6+2А12О3
А12О3 + 1,5С = 1,5СО2 +2А1
Взаимодействие алюминия с электролитом
Взаимодействие алюминия с электролитом приводит к растворению металла в солевом расплаве и переносу продуктов растворения к аноду, где они окисляются электрохимически на поверхности анода или химически анодными газами. В результате происходят бесполезные потери металла и выход по току на катоде становится меньше единицы. При производстве алюминия потери металла довольно значительны.
При растворении алюминия в криолито-глиноземных расплавах происходят две реакции: взаимодействия алюминия с фторидом алюминия с образованием субфторида алюминия
A1 + 1/2A1F3 = 3/2A1F. (25)
и обмена фторида натрия с алюминием
1/3A1 + NaF = Na + 1/3AlF3. (26)
Течение этих реакций в значительной степени определяется активностью фторидов алюминия и натрия в расплаве, т. е. криолитовым отношением и температурой.
Монофторид алюминия получается при взаимодействии фторида алюминия и алюминия при высоких температурах (начало заметного взаимодействия при 1000 °С). Реакция образования субфторида алюминия протекает главным образом в кислых расплавах, при достаточно больших активностях фторида алюминия. При повышении температуры реакция сдвигается вправо, при понижении — происходит распад субфторида на мелкодисперсный алюминий и фторид алюминия.
Реакция обмена между алюминием и фторидом натрия (26) в основном протекает в области нейтральных и щелочных электролитов. Получающийся по этой реакции натрий не выделяется в виде самостоятельной фазы, а образует раствор натрия в электролите. При этом также образуется раствор натрия в алюминий. Растворимость натрия в алюминии невелика: при 1000 °С она оценивается величиной в 0,45% (по массе). Растворы натрия в электролите, по-видимому, являются ионноэлектронными жидкостями.
Ниже приведена растворимость алюминия и натрия в электролите и натрия в алюминии при 1000 °С (Ветюков, Винокуров):
| При 1,5% (по массе) А12Оз и К.О Растворимость, % (по массе): | 1,6 | 1,8 | 2,0 | 2,5 | 3,0 | 3,2 | 3,6 |
| Na в электролите | 0,056 | 0,058 | 0,064 | 0,074 | 0,093 | 0,116 | 0,140 |
| А1 в электролите | 0,138 | 0,130 | 0,102 | 0,077 | 0,063 | 0,051 | 0,043 |
| Na в AI... | — | 0,007 | — | 0,015 | 0,019 | 0,022 | 0,032 |
| При К.О.=3 и А12О3, % (по массе) Растворимость, % (по массе): | 1,5 | 3,5 | 5,5 | 7,5 | |||
| Na в электролите | 0,093 | 0,090 | 0,087 | 0,080 | 0,065 | ||
| А1 в электролите | 0,063 | 0,068 | 0,064 | 0,055 | 0,058 | ||
| Примечание. Прочерки означают, что растворимости в данных случаях не определяли. |
С ростом криолитового отношения расплава концентрации натрия в электролите и в алюминии монотонно повышаются, что связано с увеличением активности NaF в расплаве, а концентрация алюминия в электролите понижается. Повышение концентрации глинозема при постоянном К.О. проявляется в уменьшении содержания натрия, в то же время как растворимость алюминия остается практически постоянной. Повышение температуры приводит к заметному сдвигу реакции (26) вправо: концентрация натрия в электролите при повышении температуры с 1000 до 1100 °С увеличивается в 1,5 раза; концентрация растворенного алюминия при этих же условиях повышается всего на 15%.
Несмотря на сравнительно малые растворимости алюминия и натрия в электролите, сильная циркуляция расплава в промышленных ваннах приводит к быстрому переносу катодных продуктов в анодное пространство, где они окисляются, что приводит к значительным, потерям металла.
Таблица 3. Термодинамические данные для реакций взаимодействия алюминия с электролитом
| Метод определения | Т, К | ΔGo, кДж | |
| Реакция (25) | |||
| Расчет (Костюков) | 45,48 | 1,49*10-2 | |
| Эксперимент (Ветюков, Винокуров) | 37,5 | 2,84 *10-2 | |
| Реакция (26) | |||
| Расчет (Ветюков, Борисоглебский) | 53,25 | 7,25 *10-3 | |
| Эксперимент (Дюинг) | 52,15 | 7,8*10-3 |
Как видно, активность натрия почти на порядок выше, чем субфторида алюминия в расплаве криолита и резко понижается с ростом концентрации A1F3, в то время как активность A1F возрастает. Из этого следует важный практический вывод: чтобы избежать больших потерь алюминия при электролизе за счет реакции образования натрия, криолитовое отношение электролита следует сдвигать в сторону «кислых» электролитов (К.О.= 2,6 и менее).
Взаимодействие анодных газов с электролитом
Растворение газов в расплавленных солях представляет большой интерес для технологии электролиза. Анодные газы являются сильными окислителями; переходя в электролит, они окисляют растворенный металл не только на границе электролит — газ, но и во всем объеме междуполюсного пространства.
Растворимость газов подчиняется, закону Генри — сростом давления газа над расплавом растворимость увеличивается прямо пропорционально:
Cs = kpp, (27)
Энтальпию растворения можно рассматривать состоящей из двух слагаемых: одна обусловлена образованием в расплаве микрополостей, в которые входят молекулы газа (физическое растворение), другая — взаимодействием молекул газа с частицами расплава (химическое растворение). Первая, связанная с затратами энергии, положительна, вторая, связанная с выделением энергии, отрицательна. Если имеет место чисто физическое растворение, без заметного взаимодействия жидкости и газа, то с повышением температуры растворимость газа увеличивается. При химическом взаимодействии жидкости и газа растворимость с повышением температуры уменьшается.
Для криолито-глиноземных расплавов растворимость уменьшается с повышением температуры, энтальпия растворения отрицательна (-17 кДж/моль). Процесс растворения сводится к взаимодействию СО2 с оксифторидными комплексами расплава:
AlOFx1-x + СO2= A1Fx3-x+ СO32-.
Чем выше активность комплексов AlOFx1-x, тем больше растворимость СO2 в расплаве (рис. 16, б). Повышение температуры сопровождается распадом комплексов AlOFx1-x, и растворимость СO2 уменьшается.
КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
1. Общие сведения
В условиях электролиза при прохождении тока через электрод изменяется величина электродного потенциала по сравнению с его равновесным значением. Это изменение электродного потенциала называется поляризацией электрода или перенапряжением электродной реакции. Поляризация вызвана протеканием электрохимического процесса, и поэтому всегда имеется связь между скоростью процесса, а значит, плотностью тока на электроде, и поляризацией. Задача электрохимической кинетики состоит в установлении характера этой связи, чтобы сознательно управлять течением электрохимического процесса.
Электрохимический процесс складывается из нескольких последовательных стадий: транспорта вещества к поверхности электрода, электрохимической реакции восстановления или окисления на электроде и отвода продуктов реакции. В некоторых случаях существенную роль играют химические реакции: гомогенная, протекающая в электролите вблизи поверхности электрода, и гетерогенная — на поверхности электрода. В первом случае в электрохимическую реакцию вступает не то вещество, которое транспортируется к электроду, а продукты его распада или взаимодействия с другими веществами, содержащимися в электролите. Такая реакция предшествует электрохимической стадии. Во втором случае в результате электрохимического разряда получается не конечное вещество, а некоторое промежуточное, адсорбированное электродом. Затем происходит гетерогенная реакция перехода этого вещества в конечный продукт. Иногда приходится учитывать скорости образования новой фазы, появляющейся в результате электрохимической реакции — кристаллов твердого вещества, капель металла и пузырьков газа.
В зависимости от того, какая из этих стадий является лимитирующей, т. е. самой медленной, различают следующие виды поляризации, или перенапряжения (по Феттеру).
Перенапряжение перехода вызвано замедленностью стадии разряда — ионизации. Связь между перенапряжением и плотностью тока описывается уравнением Тафеля:
η=a+b lg i (31)
где i – плотность тока, А/см2, а и b - помтоянные
Для анодного процесса
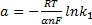 ;
; 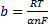
где k1 — константа скорости электрохимического процесса, 1/с; α — коэффициент переноса (кинетический коэффициент), доли. ед.
При электрохимическом процессе потенциальная энергия иона в электролите и конечного продукта на электроде различна. В энергию активации электродной реакции входит не вся разность этих энергий, а только часть ее. Коэффициент переноса и представляет собой отношение этой части энергии к полной энергии.
Для катодного процесса, в котором играет роль концентрация '(активность) потенциал-определяющих ионов, константы уравнения Тафеля будут иметь значения:
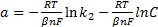 ;
; 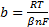
где С— концентрация ионов, моль/см3; β — коэффициент переноса для катодного процесса, доли ед.
Сумма коэффициентов переноса α и β равна единице и обычно, принимается, что α= β=0,5.
При малых поляризациях, когда ηп˂˂ RT/nF перенапряжение связано с плотностью тока соотношением
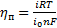 (32)
(32)
где io — плотность тока обмена, А/см2.
Любой электрохимический (и химический) процесс идет как в прямом, так и в обратном направлениях. Чем дальше процесс от равновесного, тем больше прямой процесс преобладает над обратным, и наоборот. При равновесии скорости прямого и обратного процессов равны. Ток обмена и представляет собой скорость- электрохимического процесса в прямом и обратном направлениях при равновесном потенциале. Как следует из соотношения (32), с увеличением тока обмена перенапряжение перехода уменьшается. Если i0»i, то перенапряжение близко к нулю, и процесс можно рассматривать как равновесный (обратимый).
Обычно токи обмена в расплавленных солях велики — от единиц до сотен ампер на квадратный сантиметр, что связано с ускорением процессов при высоких температурах.
Перенапряжение диффузии возникает вследствие замедленности переноса реагирующих веществ. Этот перенос может осуществляться молекулярной диффузией, миграцией (переносом под действием электрического поля заряженных частиц — катионов и анионов)и конвекцией (переносом потоком жидкости). Обычно конвекция вызвана выделяющимися на аноде газами. Эффект миграционного переноса удается в значительной степени снизить за счет создания фона, при котором перенос электричества осуществляется другими, неразряжающимися ионами. Именно такой перенос имеет место в алюминиевых электролизерах.
Основным лимитирующим процессом обычно является молекулярная диффузия как самый медленный процесс. Если диффузия происходит к плоскому электроду, то диффузионный ток (для катодного процесса) можно подсчитать из выражения первого закона Фика:
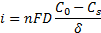
где Со — концентрация ионов в глубине электролита; Cs— концентрация ионов на поверхности электрода;. δ — толщина диффузионного слоя; D — коэффициент диффузии.
Толщина диффузионного слоя зависит от условий перемешивания электролита — чем выше скорость потоков, обтекающих электрод, тем меньше δ. При электролизе расплавленных солей толщина диффузионного слоя обычно составляет от 0,1 до 1 мм.
Для жидких электродов в расплавленных солях было отмечено (Поляков с сотр.), что толщина диффузионного слоя уменьшается за счет эффекта Марангони: межфазное натяжение на границе металл — электролит имеет разное значение на различных участках поверхности электрода, что вызывает течение жидкости от участков с меньшим межфазным натяжением к участкам с большим межфазным натяжением. Это дополнительное перемешивание может уменьшить δ на порядок.
При падении концентрации Cs до нуля получается максимальный ток диффузии — так называемый предельный диффузионный ток: id=nFDC0/δ
Связь между перенапряжением и диффузионным током дается выражением:
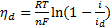 , (33)
, (33)
из которого следует, что в области предельного тока происходит резкий сдвиг потенциала в отрицательную сторону и на поляризационной кривой отмечается площадка предельного тока. Потенциал электрода при этом сдвигается настолько, что начинается разряд другого, более электроотрицательного катиона (например, катиона фона). Если строить поляризационную кривую до предельного тока, то в координатах ηd— ln (1-i/id)получается прямая, наклон которой позволяет определить п — число электронов, участвующих в электрохимической реакции.
Если перенапряжение определяется замедленностью диффузии анионов в процессе анодного разряда, то соответствующее уравнение связи между током диффузии и перенапряжением будет
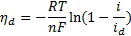
где id — предельный ток диффузии анионов, А/см2.
Перенапряжение реакции вызвано замедлением химических реакций на стадиях до или после разряда — ионизации. Рассмотрим гетерогенную реакцию, следующую после разряда, как наиболее важную для дальнейшего изложения.
Предположим, что электрохимический процесс состоит из двух последовательных стадий: окисления вещества R: R-ne↔О с образованием промежуточного окисленного вещества О, адсорбирующегося на поверхности электрода, и гетерогенной реакции О↔А, при которой образуется конечный продукт А. Допустим, что стадия разряда протекает быстро, практически равновесно, в то время как последующая гетерогенная реакция — медленно. Скорость этой медленной стадии слагается из скорости прямого процесса, пропорциональной поверхностной концентрации вещества О в степени р (порядок реакции), и скорости обратного процесса
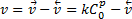
где k — константа скорости реакции, см/с.
При равновесии скорости этих процессов равны:
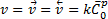 ,
,
при этом 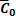 — поверхностная концентрация вещества в равновесии, моль/см2. Если в процессе имеется большой избыток вещества А и его концентрация не зависит от потенциала, то независимой будет и
— поверхностная концентрация вещества в равновесии, моль/см2. Если в процессе имеется большой избыток вещества А и его концентрация не зависит от потенциала, то независимой будет и 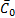 . Перенапряжение реакции определяется выражением:
. Перенапряжение реакции определяется выражением:
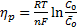 (34)
(34)
где С0—поверхностная концентрация вещества О при поляризации. Скорость процесса, или плотность тока
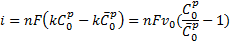
Ho nFv0=i0 — плотность тока при равновесии (ток обмена), поэтому
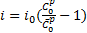 . (35)
. (35)
Из выражений (34) и (35) вытекает связь между плотностью тока и перенапряжением:
 . (36)
. (36)
Если i/i0˃˃1, то получается уравнение Тафеля:
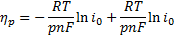
В координатах ηpэта зависимость выражается прямой линией, как и в случае перенапряжения перехода, но вместо коэффициента переноса здесь фигурирует порядок гетерогенной химической реакции р, и коэффициент b в уравнении Тафеля будет существенно меньшим.
Механизм катодного процесса
Катодный процесс включает в себя следующие последовательно идущие стадии: транспорт оксифторидных и фторидных комплексов, содержащих ионы алюминия, из глубины расплава к катоду; распад комплексов в двойном слое с образованием свободных ионов А13+ и разряд ионов А13+. Не исключено, что разряд происходит непосредственно из комплексных ионов, минуя стадию их распада.
По оценкам Тонстэда и Ролзеза, величина тока обмена на границе раздела жидкий алюминий – криолит - глиноземный расплав находится в пределах 12-36 А/см2, поэтому электрохимическая поляризация для катодного процесса незначительна. Невелика для жидкого катода и фазовая поляризация. Наиболее важное значение для катодного процесса имеет концентрационная поляризация, обусловленная разрядом, а значит, уменьшением в прикатодном слое концентрации ионов A1ОF2- и накоплением в нем избыточной (по сравнению с объемной) концентрации ионов фтора. Сказанное подтверждают результаты, приведенные на рис.2.3.
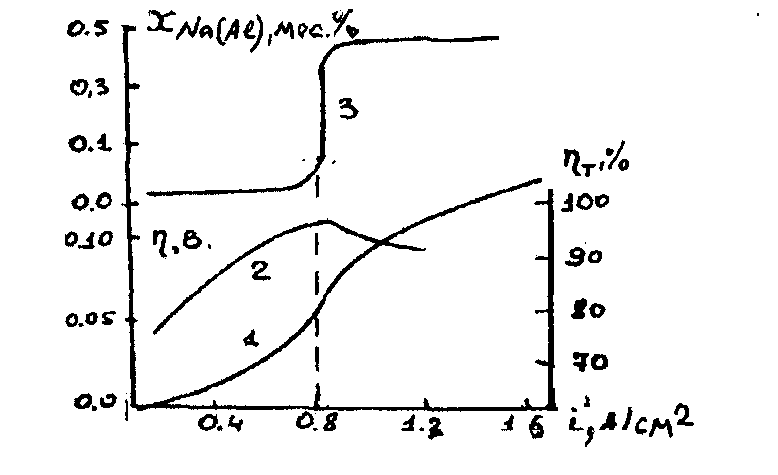
Рис.2.3. Совместное выделение алюминия и натрия
(970°С, к.о.=3,0, [А12О3]=5мас.% данные Ю.В.Борисоглебского):
1- катодная поляризационная кривая; 2 - выход по току для алюминия;
3- содержание натрия в алюминии.
Наличие площадки предельного диффузионного тока, по превышении которого скачкообразно возрастает содержание натрия в алюминии, а выход по току алюминия падает, убедительно указывает на диффузионный характер перенапряжения на алюминиевом катоде.
Выделение натрия на алюминии определяется в основном криолитовым отношением и температурой: чем они выше, тем больше выделяется натрия. Натрий уходит из алюминия двумя путями: 1) растворяется в электролите, переносится к аноду и окисляется; 2) проходит через толщу алюминия и поглощается угольной футеровкой. Первый путь приводит к значительным потерям тока и к снижению выхода по току, второй — к преждевременному разрушению угольной футеровки электролизеров.
Структура угольного анода и закономерности горения углерода
Угольные материалы — ископаемые угли, коксы и другие отличаются сложным составом и строением. В основе их структуры лежат базисные графитоподобные сетки — ядра, на периферии которых концентрируются
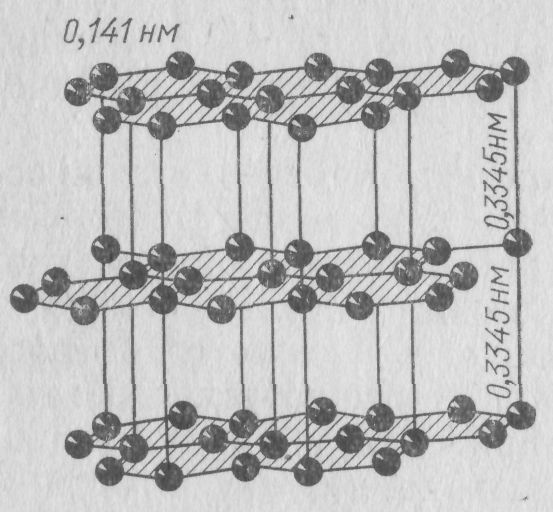
Рис. 18. Кристаллическая решетка идеального графита
атомы водорода и кислорода, образующие сложные углеводородные соединения — так называемую бахрому. При термической обработке — коксовании происходит разрушение бахромы и рост за счет этого ядра. С повышением температуры ядро перестраивается: кристаллиты укрупняются, и электропроводимость повышается, поскольку сопротивление определяется в основном границами зерен. Однако термическая обработка коксов не дает возможности достичь структуры идеального графита, даже если она проводится при температурах выше 2000 °С. Получается ра
 2015-08-12
2015-08-12 4692
4692








