Проводник электричества 1 рода, находящийся в контакте с проводником электричества П рода, называется электродом. Если два электрода поместить в электролит и подключить к противоположно заряженным полюсам источника постоянного тока (рис.3.1), то при пропускании тока на электродах пойдут различные окислительно-восстановительные процессы.
Электрод, подключенный к отрицательному полюсу источника тока, называется катодом. На нем происходят восстановительные процессы - передача электронов от электрода катионам, например:
Cu2+ + 2e = Cu. (3.1)
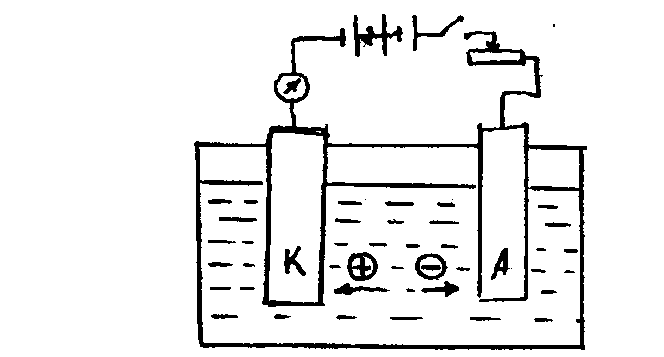
Рис.3.1.Принципиальная схема электролиза
Электрод, подключенный к положительному полюсу источника тока, называется анодом. На нем происходят окислительные процессы - передача электронов от отрицательно заряженных частиц растворов (анионов) электроду.
Например:
2Сl--2е=С12. (3.2)
Суммарный процесс при электролизе сводится к реакции
CuCl2=Cu+Cl2. (3.3)
В общем случае электролиз - это процесс, в котором химические реакции происходят на электродах под действием постоянного электрического тока.
|
|
|
Различают активные и пассивные электроды. Активные электроды (катод в рассматриваемом примере) непосредственно участвуют в электрохимическом процессе. Пассивные (или инертные) электроды (в нашем случае - анод) являются только поставщиками либо акцепторами электронов, сами в электрохимическом процессе не участвуют, не изменяют своих размеров и формы.
Связь между количеством пропущенного электричества и изменением масс веществ - участников электрохимической реакции устанавливают законы Фарадея, открытые в 1833-1834 гг.
Первый закон гласит:"Если на границе раздела проводник электричества 1 рода - проводник электричества П рода протекает одна электрохимическая реакция, то масса каждого из участников реакции, претерпевших превращение (mi), прямо пропорциональна количеству прошедшего электричества (Q)":
mi = qi Q, (3.4)
где qi - фактор пропорциональности, называемый электрохимическим эквивалентом, г/(А×ч), определяемый по формуле
qi =  , (3.5)
, (3.5)
где Mi - молекулярный вес элемента;
ni - его валентность;
F - число Фарадея; F = 96450 кул = 26,8 А×ч.
Например, молекулярный вес алюминия равен 26,98, а валентность его ионов равна 3. Подставив эти величины в уравнение (3.5), получаем
qAl = 0,3356 г/(А×ч).
Для меди двухвалентной qcu=l,1864 г/(А×ч), а для восстановления меди одновалентной qcu=2,3728 г/(А×ч).
Второй закон Фарадея является следствием первого: "Если на границе проводников 1 и П рода протекает одна реакция, в которой участвует несколько веществ, то их массы относятся друг к другу как химические эквиваленты". Действительно, согласно уравнениям (3.4) и (3.5)
|
|
|
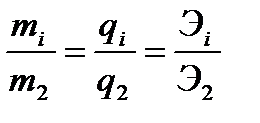 . (3.6)
. (3.6)
Например, для реакции (3.3) отношение масс меди и хлора может быть найдено из соотношения
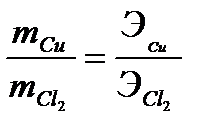 =
= 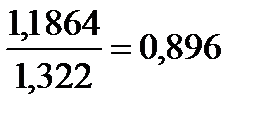 .
.
 2015-08-12
2015-08-12 1337
1337








