Типы:
| КФК-ВВ | КФК-МВ | КФК-ММ |
| В ткани мозга | В сердце – в норме; В крови – при инфаркте | В мышцах |
Для диагностики:
| Инфаркта | Заболеваний печени | Острого панкреатита |
| Тропонины КФК-МВ (через 2-3ч) Миоглобин (через час) ЛДГ-1 АСТ | АЛТ АСТ Щелочная фосфатаза Γ-ГТП Аргиназа, гистидаза (органо-специфичны) | Амилаза Липаза Трипсин |
Энзимотерапия – лечение ферментами
Виды:
| Заместительная (не хватает фермента => можно добавить) | Патогенетическая |
| Пепсин Фестал Панзинорм | Пепсин: для обработки гнойных ран и удаления вязких секретов Гиалуронидаза: для рассасывания коллоидных рубцов, спаек Ряд ферментов для лечения опухолей Коллагеназа ДНК-аза: лечение вирусных заболеваний глаз |
Структура и функции коферментов. Кофакторы. Водорастворимые витамины.
| Понятие о коферментах и кофакторах | Строение ферментов (фермент – белок катализатор) 1) Простые - из одной глобулы 2) Сложные – из двух и более полипептидов + могут иметь надмолекулярную структуру: · МультиФерментные комплексы · МультиФерментный конъюгат · Ферментный ансамбль · Интегральный ансамбль 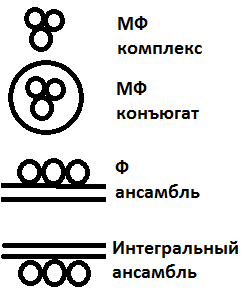 Кофермент - небелковое соединение органической природы Кофактор – неорганической природы (часто Ме) Функции коферментов: · Участие в катализе (каталитических превращениях) субстрата · Переносчик групп от субстрата к ферменту · Присоединение кофермента или кофактора стабилизирует структуру белка-фермента Химическое строение кофермента: · Производные водорастворимых витаминов · Производные пептидов · Производные нуклеотидов Витамины – пищевые незаменимые факторы, присутствующие в небольших количествах, обеспечивающие нормальное развитие организма, адекватную скорость протекания биохимических и физиологических процессов. Кофермент - небелковое соединение органической природы Кофактор – неорганической природы (часто Ме) Функции коферментов: · Участие в катализе (каталитических превращениях) субстрата · Переносчик групп от субстрата к ферменту · Присоединение кофермента или кофактора стабилизирует структуру белка-фермента Химическое строение кофермента: · Производные водорастворимых витаминов · Производные пептидов · Производные нуклеотидов Витамины – пищевые незаменимые факторы, присутствующие в небольших количествах, обеспечивающие нормальное развитие организма, адекватную скорость протекания биохимических и физиологических процессов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Классификация, структура и функции коферментов: a) Коферменты оксиредуктаз: НАД, НАДФ, ФАД, ФМН, КоQ, липоевая кислота, гем, глутатион, кофактор аскорбировая кислота b) Коферменты трансфераз: КоА, ТГФК, биотин, АТФ, УДФ-глюкоза, ПФ, УДФ-глюкуронид, ФАФС c) Коферменты лиаз: ТДФ, ПФ, кобамидные, кофактор витамин К d) Коферменты изомераз: кобамидные e) Коферменты лигаз (ситнетаз): биотин |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Связь коферментов с витаминами. Какие витамины входят в состав коферментов? |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Понятие о гипо-, гипер- и авитаминозах. Причины гипо- и авитаминозов: экзогенные и эндогенные. | Гипоавитаминоз – болезнь при недостаточном поступлении или при неполном усвоении витамина Гипервитаминозы – болезни с поступлением больших количеств витаминов в организмАвитаминозы – болезни при полном отсутствии витамина или полном нарушении усвоения витамина Причины: Экзогенные – отсутствие витамина в пище; недостаточное, неполноценное питание Эндогенные – повышенная потребность при некоторых физиологических и патологических состояниях | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
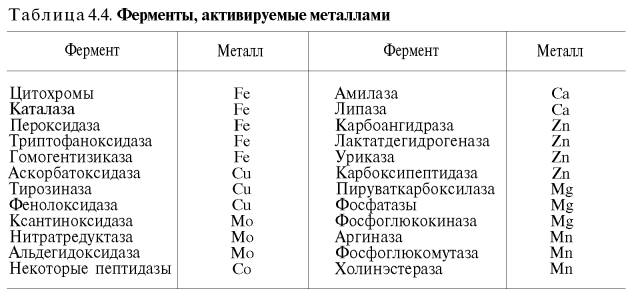
| Неорганические кофакторы (анионы и катионы). С какими ферментами они взаимодействуют? |  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные теории образования фермент-субстратного комплекса и механизма действия ферментов | 1) теории «ключа-замка» Э. Фишера - «жесткой матрицы». жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента. 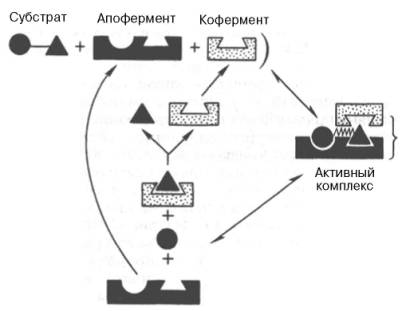 2) теория «индуцированного соответствия» Д. Кошленда Теория допускает высокую конформационную лабильность молекулы белка-фермента и гибкость и подвижность активного центра. Фермент только в присутствии (точнее, в момент присоединения) субстрата будет находиться в активной (напряженной) Т-форме в отличие от неактивной R-формы 2) теория «индуцированного соответствия» Д. Кошленда Теория допускает высокую конформационную лабильность молекулы белка-фермента и гибкость и подвижность активного центра. Фермент только в присутствии (точнее, в момент присоединения) субстрата будет находиться в активной (напряженной) Т-форме в отличие от неактивной R-формы 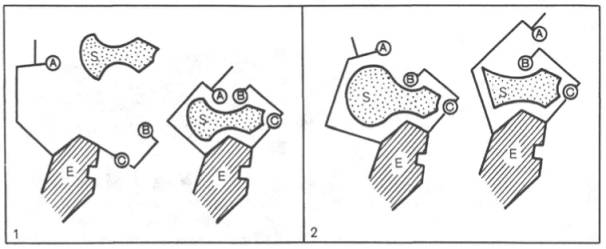 |
Характеристика витаминов: В1,В2,В3,РР,В6,Вс,В12,Н,С,Р
| Витамин | Пищевые источники, суточная потребность | Гипо-, гипер-, авитаминозы | Структура витамина | КоФ | Участие в обмене веществ |
| В1 (тиамин, антинев-ритный) | 2,0-3.0 мг Источники: Черный хлеб, злаки, отруби, горох, фасоль, мясо (печень), дрожжи. Около 50% - в мышцах, около 40% – в печени. | Авитаминоз: Бери-бери (полиневрит) — нарушение метаболизма пище- варительной, сердечно-сосудистой и нервной систем из-за недостаточности энерге- тического и пластического обменов. - снижение периферической чувствительности, - утрата некоторых рефлексов, - боли по ходу нервов, - энцефалопатия (синдром), - ретроградная амнезия (синдром Корсакова) | 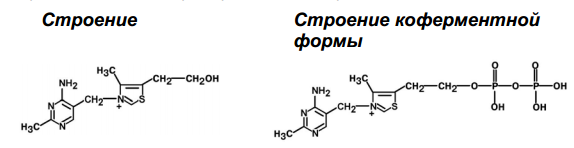 | ТДФ (тиаминдифосфат)  | - Окислительное декарбоксилирование α-кетокислот (ПВК), в цикле Кребса, в пентозном цикле. - Передача нервного импульса. - Способствует пролонгированному действию катехоламинов в ЦНС. Метаболизм: Всасывается в тонком кишечнике в виде свободного тиамина. 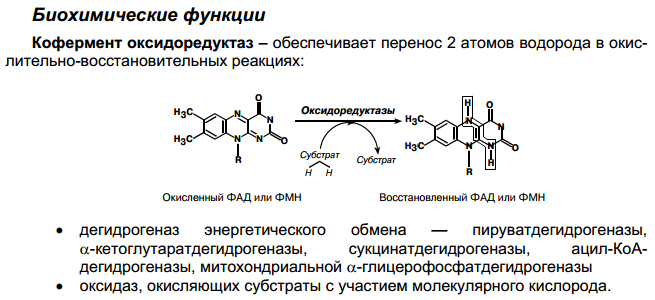 |
| В2 (рибо-флавин, витамин роста) | 2,0-2,5 мг Источники: мясные продукты, печень, почки, молочные продукты, капуста, горох, яблоки, фасоль, дрожжи; образуется кишечными бактериями. | Расстройство пищеварения, нервной системы, общая слабость, снижение сопротивляемости болезням, кожные заболевания (поражение слизистых – сухость рта губ, роговицы, трещины в уголках рта и губах, шелушение кожи из-за снижения роста эпителия. сухость конъюктивы, ее воспаление и васкуляризация роговицы) | 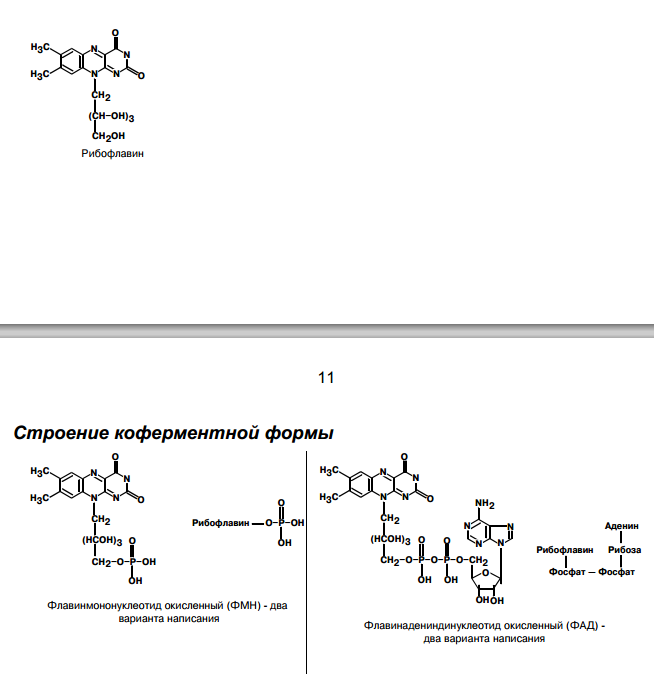 | ФАД, ФМН   | тканевое дыхание, перенос Н+ и электронов Метаболизм: В кишечнике рибофлавин освобождается из пищевых ФМН и ФАД, диффундирует в кровь. В слизистой кишечника и других тканях вновь образуется ФМН и ФАД. |
| В3, В5 (пантоте-новая кислота) | 10-15 мг Источники: бобовые, дрожжи, животные продукты | Обычно отсутствует, т.к. витамин есть во всех продуктах. В эксперименте прояв- ляется поседение волос, поражение кожи, дисфункции нервной системы, апатия, депрессия, мышечная слабость. | 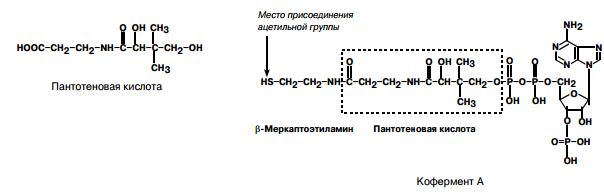 |  | Перенос ацильных групп в реакциях: 1. окисления пирувата, окисления и синтеза жирных кислот; 2. синтеза ацетилхолина и гликозаминогликанов; 3. обезвреживания биогенных аминов и образования гиппуровой кислоты. |
| РР – (ниацин, антипел-ларги-ческий) | 15-25 мг Источники: Дрожжи, мясо, рыба, сыр (в молоке и яйцах мало). | Пеллагра (болезнь 3Д): 1) деменция (нервные и психические расстройства, слабоумие), 2) дерматит (фотодерматиты), 3) диарея (слабость, расстройство пищеварения, потеря аппетита). При отсутствии лечения заболевание кончается летально. У детей наблюдается замедление роста, похудание, анемия. | 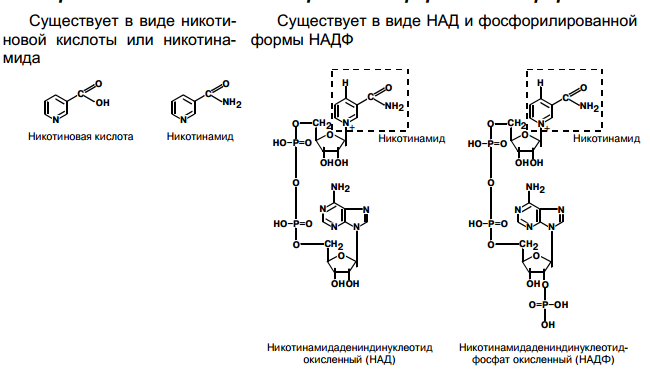 |  НАД, НАДФ НАД, НАДФ | тканевое дыхание, перенос Н+ и электронов Метаболизм: Синтезируется в организме из триптофана (1 молекула витамина на 60 молекул АК) 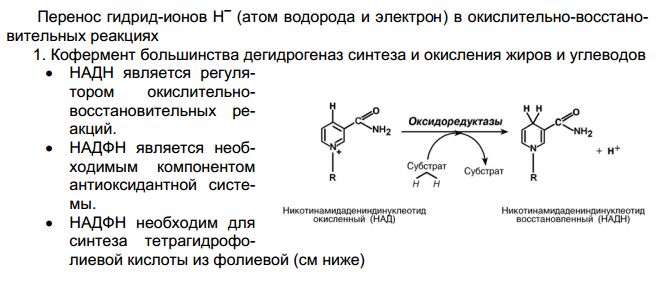 |
| В6 (пири-доксин, анти-дерма-титный) | 1,5-2,0 мг Источники: дрожжи, печень, черный хлеб, каши из недробленых круп, хлеб из муки грубого помола, мясо, рыба, печень, дрожжи, растительные продукты злаки, бобовые, дрожжи, мясные продукты, + синтези-руется кишечными бактериями. | Повышенная возбудимость ЦНС, судороги (из-за недостатка синтеза ГАМК), полиневриты. пеллагроподобные дерматиты. | 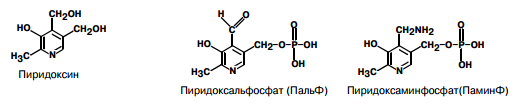 | ФП (ПФ)   | Декарбоксилирование АК Перенос аминогрупп и карбоксильных групп. 1. Кофермент аминотрансфераз – участие в метаболизме аминокислот. 2. Кофермент декарбоксилаз – синтез биогенных аминов. 3. Кофермент фосфорилазы гликогена (50% всего витамина находится в мыш- цах) 4. Участие в синтезе гема, никотинамида из триптофана, сфинголипидов. |
| В9 = Вс (фолие-вая кислота) | 400 мкг Источники: листья шпината, салата, дрожжи, печень, черный хлеб, томаты, злаки, говядина, яичный желток | Макроцитарная анемия (Мегалобластическая) – нарушение синтеза пуринов и дТТФ, что влечет снижение синтеза ДНК и скорости деления клеток. Клетки не теряют способности расти, но не делятся. Лейкопения – по той же причине. Поражение слизистых: гастриты, энтериты, конъюктивит, глоссит. Замедление роста, ухудшение заживления ран, иммунодефициты. | 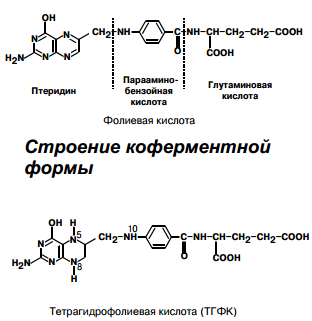 |  ТГФК ТГФК | перенос одноуглеродных остатков (-СН2-, -СОН-, -СН2ОН-, -СН-, -NН) 1. Участие в синтезе пуриновых и пиримидиновых оснований 2. Участие в обмене аминокислот: обратимое превращение глицина и серина, синтез метионина из гомоцистеина. |
| В12 (циан-коба-ламин) | 2.5-5.0 мкг Источники: только животные продукты: печень рыба, почки, мясо +микро-флора кишечника | снижение кислотности желудочного сока - Макроцитарная анемия, (количество эритроцитов снижено в 3-4 раза). Причиной потеря фолиевой кислоты клетками при недостаточности витамина В12 => нарушение синтеза пуринов и дТМФ. - Неврологические нарушения: онемении кистей, стоп, ухудшении памяти(накопление нечетных жирных кислот вызывает жировую дистрофию нейронов и демиелинизацию нервных волокон), нехватка метионина опосредует снижение активности реакций метилирования и уменьшает синтез ацетилхолина Пернициозная анемия Аддисон-Бирмера – аутоиммунное заболевание, при ко- тором образуются антитела против обкладочных клеток желудка либо против внутреннего фактора Кастла. | Содержит 4 пиррольных кольца, ион кобальта (с валентностью от Co3+ до Co6+), группу CN- | В организме при синтезе коферментных форм группа CN- заменяется на метил, 5-дезокси-аденозил, нитрит, ОН-группу. | 1) перенос водорода внутри молекулы, 2) обмен липидов, 3) образование дезоксирибозы из рибозы, 4) влияние на созревание эритроцитов Метаболизм: Для всасывания необходим внутренний фактор Кастла (гликопротеин, синтезируемый обкладочными клетками желудка) В крови ранспортируется в виде гидрокси-кобаламина специфическими транспортными белками (α- и β-глобулинами).   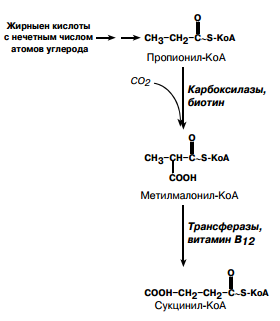 |
| Н (биотин, анти-себо-рейный) | 150-200 мкг Источники: печень, почки, горох, соя, цветная капуста, грибы, яичный желток, лук, цельная мука +синтез в кишечнике | Авитаминоз: себорейный дерматит (облысение), его можно вызвать поедая белок яйца (там содержится авидин, связывающий биотин) | 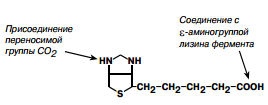 | Биотин | 1) Перенос СО2 в реакциях карбоксилирования, транскарбоксилиро-вания 2) синтез жирных кислот 1. Находится в составе пируваткарбоксилазы (глюконеогенез), 2. Находится в составе ацетил-КоА-карбоксилазы (синтез жирных кислот), 3. Находится в составе пропионил-КоА-карбоксилазы (окисление пропионила. до СО2 и Н2О). 4. Участвует в распаде лейцина. |
| С (аскор-биновая кислота, антицин-говый) | 100 мг Источники: Овощи и фрукты: редька, хрен, шиповник, ягоды рябины, черной смородины, цитрусовые, капуста, шпинат | Цинга — приводит к ломкости и проницаемости капилляров (нарушение синтеза коллагена и хондроитин-сульфата) В результате ухудшается заживление ран. Снижается всасываемость железа в кишечнике и умень-шается активность фолиевой кислоты – это приводит к анемии. Нарушение иммунитета, особенно легочного, быстрая утомляемость. У детей - болезнь Меллера-Барлоу (поражение костей) | 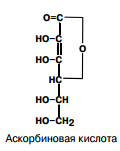 | 1) Антиоксидант, 2) синтез коллагена, 3) способствует усвоению железа и нормальному кроветворению, 4) принимает участие в обмене холестерина, 5) участвует в ОВР, 6) улучшает самочувствие, настроение, стимулирует работу ЦНС 7) синтез гормонов коры надпочечников  | |
| Р (рутин, цитрин, витамин проница-емости) | Суточная потребность – не установлена Источники: овощи и фрукты, в которых много С | При недостаточности или отсутствии: повышается проницаемость сосудов, сопровождающаяся кровоизлияниями и кровотечениями. Общая слабость, быстрая утомляемость и боли в конечностях | Группа веществ со сходной биологической активностью: катехины, халконы, дигидрохалконы, флавины, флавоны, изофлавоны… | 1) стабилизируют основное вещество соединительной ткани путем ингибирования гиалуронидазы 2) ОВР (как и С) | |
| Витаминоподобные вещества | |||||
| В15 (пан-гамовая кислота) | Суточная потребность – не установлена Источники: печень, семена растений, дрожжи | Эфир глюконовой кислоты и диметилглицина | 1) Помогает при нарушении процессов обменах, жировом перерожде-нии печени и некоторых формах кислородного голодания 2) Возможное участие в биосинтезе холина, метионина и креатина | ||
| Липое-вая кислота | Суточная потребность – не установлена Источники: дрожжи, печень | 1) Окисление и перенос ацильных групп в составе многокомпонентных ферментных систем 2) Прямое участие в окислительном декарбоксилировании в тканях α-кетокислот |
| Антивитамины, применение в лечебной практике | Антивитамины - любые вещества, вызывающие независимо от механизма их действия снижение или полную потерю биологической активности витаминов.
Большинство этих антивитаминов применяют как лечебные средства со строго направленным действием на некоторые биохимические и физиологические процессы.
|
| Витамин А (ретинол антиксе-рофталь-мичес-кий витамин) | 2,7 мг Источники: Печень к/р/с и свиней, яичный желток, цельное молоко, масло, сметана, сливки, печень морского окуня, трески, палтуса, красно-мякотные овощи (морковь, томаты…) | Гипоавитаминоз: Торможение роста, снижение массы тела, общее истощение организма, специфические поражения кожи, слизистых оболочек… Поражение эпителия: пролиферация и патологическое ороговение, развитие фолликулярного гиперкератоза, кожа шелушится и сухая => вторичные гнойные и гнилостные процессы Поражение глазного яблока (ксерофтальмия): Сухость роговой оболочки глаза, вследствие закупорки слезного канала => отек, воспаление конъюнктивы, кератомаляция Авитаминоз: Куринная слепота (гемералопия) – потеря способности различать предметы в сумерках Гиперавитаминоз: Воспаление глаз, гиперкератоз, выпадение волос, общее истощение организма, потеря аппетита, головные боли, тошнота, рвота, бессонница | 3 витамина А: А1, А2 и цис-форма А1 (невитамин А). Ретинол – циклический непредельный одноатомный спирт, состоящий из шестичленного кольца (βионон), двух остатков изопрена и первичной спиртовой группы А2 отличается наличием дополнительной двойной связи в кольце βионон 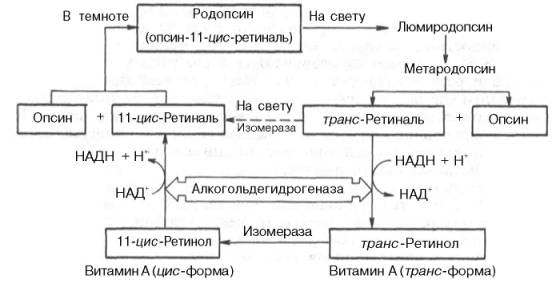 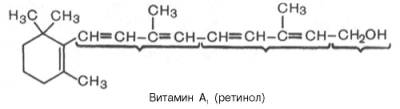 | 1) Окисляется альдегидами витамина А (ретиналями) 2) Влияние на барьерную функцию кожи, слизистых оболочек, проницаемость клеточных мембран 3) Биосинтез гликопротеинов 4) Участие в ОВР (способен образовывать перекиси) 5) Процесс свето-ощущения (родопсин состоит из липопротеина опсина и простетической группы – ретиналь) |
| Витамин D (кальции-ферол, антира-хити-ческий витамин) | 10-25 мкг Источники: продукты животного происхождения (сливочное масло, желток яиц, печень), жирах, рыбий жир, растительные масла, дрожжи + рекомен-дуется УФ-облучение кожи | Гиповитаминоз: Рахит (изменения фосфорно-кальциевого обмена и нарушение отложения в костной ткани фосфата кальция) => остеомаляция (размягчение костей) => О-или Х-образные формы, рахитические четки, задержвивается появление первых зубов и формирование дентина Остеопороз (вымывание солей из костей) => хрупкие кости => переломы Гиперавитаминоз: Смертельный исход Увеличение отложениея гидроксилапатита в костях и некоторых внутренних органах, кальцификация почек | В виде нескольких соединений: D2 (эргостерин), D3 (холестерин) 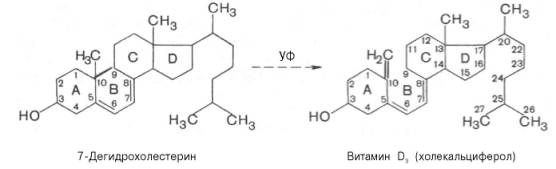 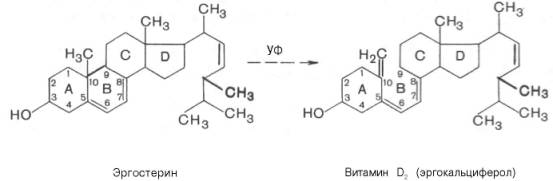 Одноатомный ненасыщенный циклический спирт, в основе лежит конденсированная кольцевая система циктопетанпергидро-фенантрена Одноатомный ненасыщенный циклический спирт, в основе лежит конденсированная кольцевая система циктопетанпергидро-фенантрена | 1) Гормональная 2) Гомеостатическая регуляция обмена кальция и минерализации костной ткани 3) Участвует в регуляции процессов всасывание Са и Р в кишечнике, резорбции костной ткани и реабсорбции Са и Р в почечных канальцах |
| Витамин Е (токо-ферол) | 5 мкг Источники: Растительные масла (под-солнечное, хлопковое, соевое…), мясо, сливочное масло, яичный желток | Авитаминоз: Гиповитаминоз: Бесплодие, мышечная дистрофия, жировая инфильтрация печени, дегенерация спинного мозга | Производные 2-метил-2-хроман-6-ола (токол) 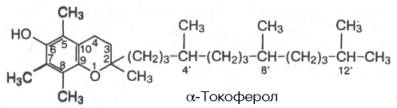 | Тканевое дыхание: 1) Главные природные жирорастворимые антиоксиданты 2) Роль в обмене селена 3) Предотвращение аутоокисления липидов биомембран |
| Витамин К (антиге-морра-гический фактор) | 1 мг Источники: Зеленые листья каштана, крапивы люцерны, капуста, шпинат, тыква, ягоды рябины, печень свиньи… | Авитаминоз: - при нарушениях всасывания жиров Самопроизвольные паренхиматозные и капиллярные кровотечения (носовые кровотечения, внутренние кровоизлияния) 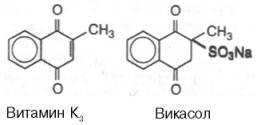 | К1 – филлохинон, К2 – менахинон, К3 - викасол В основе циклической структуры кольцо 1,4-нафтохинона 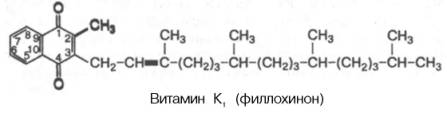 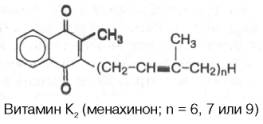 | Участие в синтезе протромбина в печени +синтез кишечной микрофлорой |
Кинетика ферментативных реакций. Влияние активаторов и ингибиторов на активность ферментов. Регуляция скорости ферментативных реакций.
| 1. Понятие о кинетике ферментативных реакций | Кинетика – скорость протекания реакции в оптимальных условиях. Оптимальные условия: температура, рН, концентрация субстрата и фермента, влияние активаторов и ингибиторов, химическая природа реагирующих вещест, концентрация кофермента и кофактора. Кинетика ферментативных реакций - изучает закономерности протекания во времени ферментативных реакций, а также их механизм.  Превращение вещества S (субстрата) в продукт P под действием фермента E протекает с образованием промежуточного соединения Xi (где ki - константы скорости отдельных элементарных стадий, KS - константа равновесия образования фермент-субстратного комплекса X1 (ES, комплекс Михаэлиса)) Превращение вещества S (субстрата) в продукт P под действием фермента E протекает с образованием промежуточного соединения Xi (где ki - константы скорости отдельных элементарных стадий, KS - константа равновесия образования фермент-субстратного комплекса X1 (ES, комплекс Михаэлиса)) | |||||||||||||||||
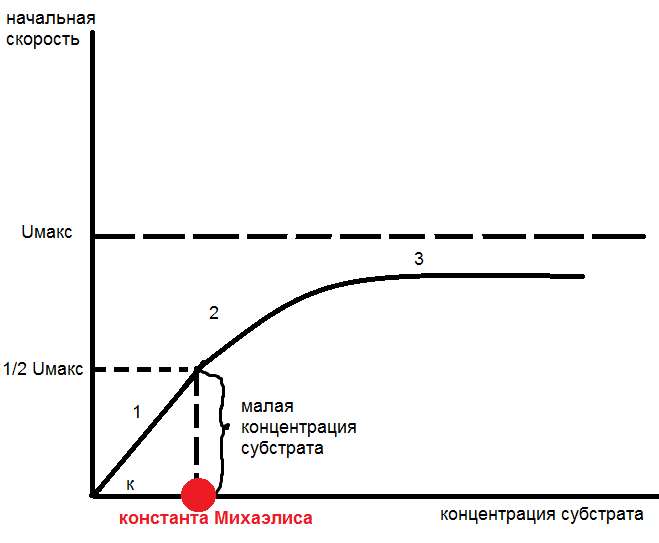
| 2. Влияние на скорость ферментативной реакции: рН среды, температуры, концентрации субстрата и фермента. Константа Михаэлиса. | Влияние на скорость ферментативной реакции: 1) 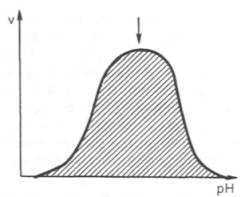 рН среды Ферменты обычно наиболее активны в пределах узкой зоны концентрации водородных ионов (в основном рН 6,0–8,0) Оптимум рН среды для действия данного фермента - точка, в которой фермент проявляет максимальную активность. рН среды Ферменты обычно наиболее активны в пределах узкой зоны концентрации водородных ионов (в основном рН 6,0–8,0) Оптимум рН среды для действия данного фермента - точка, в которой фермент проявляет максимальную активность.  Согласно современным представлениям, влияние изменений рН среды на молекулу фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (в частности, СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина, NH2-группы лизина и др.) При резких сдвигах от оптимума рН среды ферменты могут подвергаться конформационным изменениям, приводящим к потере активности вследствие денатурации или изменения заряда молекулы фермента. При разных значениях рН среды активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса. Имеет значение, кроме того, состояние ионизации субстратов и кофакторов. 2) Температуры(термолабильность) Катализируемые ферментами реакции чувствительны к изменениям температуры => скорость химических реакций зависит от температуры. Температурный коэффициент -скорость большинства биохимических реакций повышается в 2 раза при повышениитемпературы на 10°Си, наоборот, снижается в 2 раза при понижении температуры на 10°С. Но вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. При температуре, не превышающей 45–50°С, скорость реакции увеличивается согласно теории химической кинетики. При температуре выше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса. Согласно современным представлениям, влияние изменений рН среды на молекулу фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (в частности, СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина, NH2-группы лизина и др.) При резких сдвигах от оптимума рН среды ферменты могут подвергаться конформационным изменениям, приводящим к потере активности вследствие денатурации или изменения заряда молекулы фермента. При разных значениях рН среды активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса. Имеет значение, кроме того, состояние ионизации субстратов и кофакторов. 2) Температуры(термолабильность) Катализируемые ферментами реакции чувствительны к изменениям температуры => скорость химических реакций зависит от температуры. Температурный коэффициент -скорость большинства биохимических реакций повышается в 2 раза при повышениитемпературы на 10°Си, наоборот, снижается в 2 раза при понижении температуры на 10°С. Но вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. При температуре, не превышающей 45–50°С, скорость реакции увеличивается согласно теории химической кинетики. При температуре выше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса. 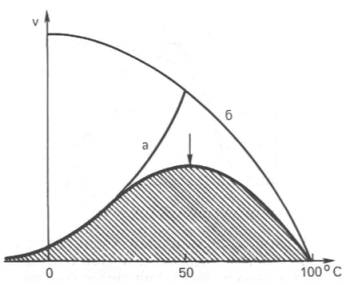 Таким образом, термолабильность, или чувствительность к повышению температуры – одно из характерных свойств ферментов, резко отличающих их от неорганических катализаторов. Таким образом, термолабильность, или чувствительность к повышению температуры – одно из характерных свойств ферментов, резко отличающих их от неорганических катализаторов.
3) Зависимость скорости от концентрации фермента прямая. (где При высокой концентрации субстрата – скорость максимальна Константа Михаэлиса (Кмих) – концентрация субстрата, при которой скорость реакции = ½ (половина) скорости максимальной. Каждый фермент имеет свою Кмих. Кмих характеризует каталитическую активность фермента => чем меньше Кмих, тем активнее фермент. | |||||||||||||||||
| 3. Виды активации ферментов: ковалентная модификация (ограниченный протеолиз, присоединение различных групп), нековавлентное активирование (аллостерическое), активация ионами | Активаторы – вещества повышающие скорость ферментативной реакции.
Виды активации ферментов:
 Сейчас читают про:
|
 2015-08-13
2015-08-13 7159
7159
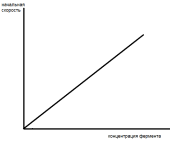 Концентрации фермента
Концентрации фермента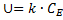
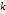 - константа скорости – зависит от природы реагирующих веществ;
- константа скорости – зависит от природы реагирующих веществ; 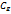 - концентрация фермента)
- концентрация фермента)