Установлено, что частицы лиофобных золей имеют мицеллярное строение. Исходя из строения мицеллы, объясняют их поведение в различных условиях,
в том числе и в электрическом поле.
Мицелла в целом электронейтральная частица и состоит из:
а) электронейтрального ядра, представляющего собой микрокристалл или агрегат молекул низкомолекулярных соединений (например, mFe(OH)3,
где т = 20…500);
б) адсорбционного слоя, в который входят с большим суммарным количеством зарядов потенциалопределяющие ионы и с меньшим суммарным количеством зарядов – противоионы (например, пFeO+(n – x)Cl-, где nFeO+ – потенциалопределяющие ионы, (n – x)Cl- -противоионы);
в) диффузного слоя, включающего в себя такое дополнительное количество противоионов, которое необходимо для полной нейтрализации зарядов, имеющихся в мицелле, потенциалопределяющих ионов (например, xCl-).
| mFe(OH)3 |
| FeO+ |
| FeO+ |
| FeO+ |
| FeO+ |
| FeO+ |
| FeO+ |
| FeO+ |
| FeO+ |
| Cl– |
| Cl– |
| Cl– |
| Cl– |
| Cl– |
| Cl– |
| Cl– |
| Cl– |
| Cl– |
| Cl– |
| Cl– |
Рисунок 1 Схема строения мицеллы гидрозоля Fe(OH)3
Таким образом, вокруг ядра находится двойной электрический слой, один слой которого образован потенциалопределяющими ионами FeO+, а другой – противоионами Cl¯. Одна часть противоионов Cl¯ находится в адсорбционном слое, а другая часть – в диффузном слое (рисунок 1).
Формула мицеллы золя гидроксида железа:
{(mFe(OH)3)nFeO+(n – x)Cl-)}x+xCl-
Та часть мицеллы, которая находится внутри фигурных скобок, называется гранулой. Гранула представляет собой компактную частицу, состоящую из ядра и ионов адсорбционного слоя. В различных условиях гранула ведет себя как единое целое, то есть ионы адсорбционного слоя прочно прикреплены к ядру. По этой причине поведение коллоидных систем определяется величиной заряда ядра – электрокинетическим потенциалом (другие названия дзета-потенциал, ς-потенциал). Для устойчивых коллоидных систем 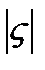 >25 мВ.
>25 мВ.
Наличие диффузного слоя мицеллы обусловлено тепловым движением молекул дисперсионной среды и самих противоионов.
Для коллоидных систем различают 2 вида устойчивости:
а) агрегативная устойчивость – способность частиц коллоидной системы оказывать сопротивление их слипанию и тем самым удерживать определенную степень дисперсности дисперсной фазы;
б) кинетическая устойчивость – способность частиц дисперсной фазы удерживаться во взвешенном состоянии под действием броуновского движения.
Агрегативная устойчивость обусловлена:
– наличием у гранул одноименных зарядов;
– наличием диффузного слоя вокруг гранул, который оказывает расклинивающее действие при их сближении.
При изменении условий коллоидная система сначала теряет агрегативную устойчивость – происходит укрупнение частиц дисперсной фазы, затем – кинетическую устойчивость (частицы выпадают в осадок или всплывают на поверхность). Подобное изменение состояния коллоидной системы, приводящее к укрупнению частиц дисперсной фазы, называется коагуляцией.
Коагуляцию можно вызвать путем добавления электролитов в коллоидную систему. По характеру взаимодействия ионов добавленного электролита на мицеллу золя различают концентрационную и нейтрализационную коагуляцию.
Нейтрализационная коагуляция происходит, если ионы добавленного электролита вступают в ионообменное взаимодействие с гранулой мицеллы. Влияние знака и величины заряда коагулирующего иона определяется правилом Шульце-Гарди: коагулирующим действием обладает лишь тот ион, который имеет заряд, противоположный заряду гранулы, причем его коагулирующая способность выражается тем сильнее, чем выше заряд иона.
Коагулирующий ион, имея более высокую величину заряда и более высокую адсорбируемость, проникает в гранулу, что приводит к нейтрализации ее заряда – z- потенциал уменьшается. По этой причине часть противоионов покидают диффузный слой – происходит сжатие диффузного слоя. Таким образом, уменьшается действие обоих факторов агрегативной устойчивости, что вызывает коагуляцию золя. Концентрационная коагуляция происходит, если ионы электролита не вступают в ионообменное взаимодействие с гранулой мицеллы. Обычно это происходит при добавлении электролитов, содержащих одновалентные ионы. Ионы добавленного электролита снижают активность молекул дисперсионной среды. Поэтому часть ионов диффузного слоя мицеллы переходят в адсорбционный слой, что приводит к снижению z-потенциала и сжатию диффузного слоя. Следует отметить, что порог коагуляции обычно при концентрационной коагуляции намного выше, чем при нейтрализационной коагуляции. Порог коагуляции – это минимальное количество электролита (ммоль-экв), которое вызывает явную коагуляцию 1 л золя.
Перед решением задач необходимо уяснить:
1) Дисперсные системы и их виды;
2) Концентрация растворенного вещества, виды концентраций;
3) Законы Рауля;
4) Закон Вант-Гоффа;
5) Температура кипения, температура замерзания раствора;
6) Криоскопическая и эбуллиоскопическая константы;
8) Осмос, осмотическое давление;
9) Изотонический коэффициент;
10) Степень диссоциации;
12) Закон разбавления Оствальда;
13) Ионные уравнения;
14) Ионная сила раствора;
15) Ионное произведение воды, рН и рОН;
16) Гидролиз солей;
17) Расчет рН водных растворов кислот, оснований и солей.
18) Растворимость, произведение растворимости;
19) Условия образования и растворения осадка;
20) Коллоидные системы. Строение мицеллы. Коагуляция электролитами. Правило Шульце – Гарди.
 2015-08-13
2015-08-13 758
758








