У воднеподiбному атомi навколо ядра з зарядом 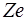 (
(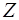 - порядковий номер хiмiчного елементу) рухається тiльки один електрон. Потенцiйна енергiя взаємодiї його з ядром дорiвнює:
- порядковий номер хiмiчного елементу) рухається тiльки один електрон. Потенцiйна енергiя взаємодiї його з ядром дорiвнює:
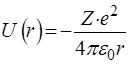 . (76)
. (76)
На рисунку 8 показано криву 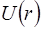 . З нього видно, що водневоподiбний атом можна розглядати як своєрiдну потенцiйну яму, обмежену потенцiйною кривою. Електрон у цiй ямi володiє негативною енергiєю.
. З нього видно, що водневоподiбний атом можна розглядати як своєрiдну потенцiйну яму, обмежену потенцiйною кривою. Електрон у цiй ямi володiє негативною енергiєю.
Пiдставляючи (76) у (14), одержимо рiвняння Шредiнгера, яке описує стацiонарний стан водневоподiбного атому:
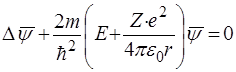 . (77)
. (77)

Рис. 8. Залежнiсть енергiї взаємодiї електрону з ядром
воднеподiбного атома вiд вiдстанi.
Рiшення цього рiвняння дає наступні основні результати.
1. Електрон у водневоподiбному атомi володiє дискретним енергетичним спектром. Власнi значення енергiї визначаються формулою:
 , (78)
, (78)
де 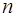 - головне квантове число.
- головне квантове число.
На рисунку 8 показане розташування енергетичних рiвнiв у водневоподiбному атомi.
2. Орбiтальний момент кiлькостi руху електрона може приймати лише наступний ряд дискретних значень:
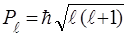 , (79)
, (79)
де 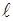 - орбiтальне (азимутальне) квантове число.
- орбiтальне (азимутальне) квантове число.
Воно може приймати будь-які значення з наступного цiлочисельного ряду:

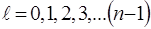 (80)
(80)
- усього 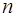 значень.
значень.
3. Стан з 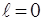 (при будь-якому
(при будь-якому 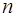 ) прийнято називати
) прийнято називати 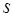 -станом,
-станом, 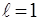 -
- 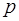 -станом,
-станом, 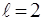 - d -станом,
- d -станом, 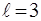 -
- 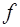 -станом і т.д.
-станом і т.д.
4. Орбiтальний момент кiлькостi руху може орiєнтуватися вiдносно вибраного напрямку 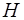 лише таким чином, що проекцiя його на цей напрямок цiлократна
лише таким чином, що проекцiя його на цей напрямок цiлократна 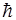 (рис. 9):
(рис. 9):
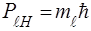 . (81)
. (81)
Число 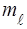 зветься магнiтним квантовим числом. Воно може приймати усi цiлочисельнi значення вiд
зветься магнiтним квантовим числом. Воно може приймати усi цiлочисельнi значення вiд 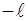 до
до 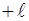 , включаючи нуль:
, включаючи нуль:
 (82)
(82)
- усього 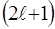 значень.
значень.

Рис. 9. Орiєнтацiя орбiтального моменту кiлькостi руху вiдносно обраного напрямку Н.
 2015-08-21
2015-08-21 291
291








