1. Стан електорну у водневоподiбному атомi визначається трьома квантовими числами - головним 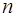 , що характеризує енергiю
, що характеризує енергiю 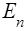 ; орбiтальним
; орбiтальним 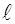 , що визначає орбiтальний момент кiлькостi руху електрона
, що визначає орбiтальний момент кiлькостi руху електрона 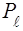 , та магнiтним
, та магнiтним 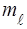 , що характеризує орiєнтацiю
, що характеризує орiєнтацiю 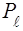 вiдносно вибраного напрямку.
вiдносно вибраного напрямку.
2. Цi стани описуються власними хвильовими функцiями 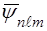 , якi є рiшеннями рiвняння Шредiнгера (77).
, якi є рiшеннями рiвняння Шредiнгера (77).
3. Iмовiрнiсть знаходження електрону у кульковому шарi товщиною 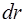 , замкненому помiж
, замкненому помiж 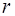 та
та 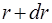 , дорiвнює добутку
, дорiвнює добутку  на об'єм цього шару
на об'єм цього шару 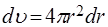 :
:
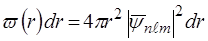 . (83)
. (83)
Щільність iмовiрностi знаходження електрону на вiдстанi r вiд ядра дорiвнює 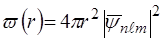 .
.
Перехiд до багатоелектронних атомiв
У багатоелектронних атомах валентний електрон взаємодiє не тiльки з ядром, але й з iншими електронами, внаслiдок чого у виразi для потенцiйної енергiї з'являються додатковi члени, якi вiдповiдають цю взаємодiю. Наявнiсть таких членiв не дозволяє одержати точне рiшення рiвняння Шредiнгера. Тому вдаються до наближених методів рiшення.
У простiших випадках рахують, що потенцiал взаємодiї валентного електрону з електронною оболонкою являється приблизно сферично симетричним i задачу вирiшують, як для водневоподiбного атому. Природньо, що таке рiшення повинно мати багато спiльного з рiшенням задачi про водневоподiбний атом. Зокрема, стан електрону у атомi характеризується завданням таких же трьох квантових чисел, що й стан у атомi водню. Проте вiдхилення потенцiалу поля вiд чисто кулонiвського, що викликане взаємодiєю електронiв мiж собою, призводить до того, що енергiя електрону стає функцiєю не тiльки головного, але й орбiтального квантового числа 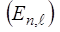 .
.
Спiн електрону
Iз загальних принципiв квантової механiки випливає, що крiм маси та заряду, електрон повинен володiти власним моментом кiлькостi руху 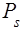 :
:
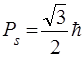 . (84)
. (84)
Гiпотеза про iснування цього моменту була вперше висунута у 1927 р. Гаудсмiтом та Уленбеком для пояснення законо-мiрностей у лiнiйчастих спектрах та експериментально доведена Штерном і Герлахом. На початку припускалось, що власний момент кiлькостi руху виникає внаслiдок обертання електрона навколо власної осi. Тому вiн одержав назву спiну (вiд англiйського "spin" - обертання, веретено). Проте таке уявлення про спiн є первiсним, невiд'ємною властивiстю електрону, що не зводиться до бiльш простого.
Проекцiя спiну на напрямок 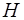 може мати лише два значення:
може мати лише два значення:
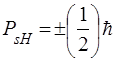 . (85)
. (85)
По аналогiї з формулою (81), цей вираз можна записати таким чином:
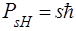 , (86)
, (86)
де 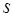 називається спiновим квантовим числом. Iз порiвняння (85) та (86) видно, що
називається спiновим квантовим числом. Iз порiвняння (85) та (86) видно, що 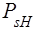 може приймати тiльки два значення:
може приймати тiльки два значення: 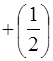 та
та 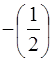 .
.
 2015-08-21
2015-08-21 356
356








