Пример 1. Вычислите изменение энтропии 1 кг этиленгликоля при его нагреве от температуры 100 до 300 оС.
Решение. Используя справочную литературу,определим коэффициенты температурных зависимостей теплоемкостей жидкого и газообразного этиленгликоля, температуру фазового превращения 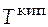 и величину мольной энтропии фазового превращения.
и величину мольной энтропии фазового превращения.
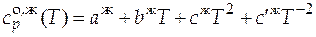 = 151,0 Дж/(моль×К).
= 151,0 Дж/(моль×К).
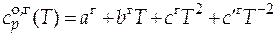 =
=
= 46,26 + 0,2005 T - 77,90×10-6 T 2 Дж/(моль×К).
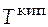 = 479,4 К.
= 479,4 К.
Мольная энтропии испарения 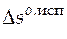 = 103,4 Дж/(моль·К).
= 103,4 Дж/(моль·К).
Производим расчеты.
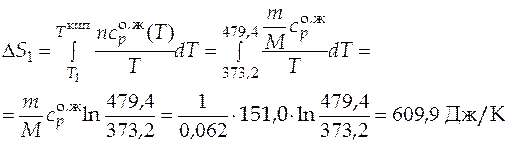
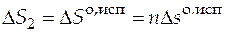 =
= 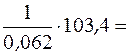 1667,7 Дж/К.
1667,7 Дж/К.
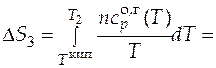
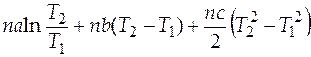 =
=
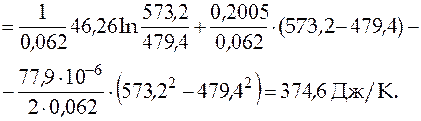
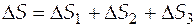 = 2652,2 Дж/К = 2,65 кДж/К.
= 2652,2 Дж/К = 2,65 кДж/К.
Пример 2. Чему равна мольная энтропия этиленгликоля при температуре 350 К?
Решение. Формула (3.14) для расчета абсолютного значения энтропии при определенной температуре в рассматриваемом примере упрощается. В качестве нижнего уровня отсчета можно использовать абсолютное значение энтропии при 298 К и давлении 1 атм. Это справочная величина, она равна 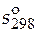 = 167,32 Дж/(моль×К). Выражение для расчета абсолютного значения мольной энтропии этиленгликоля при 350 К будет иметь вид
= 167,32 Дж/(моль×К). Выражение для расчета абсолютного значения мольной энтропии этиленгликоля при 350 К будет иметь вид
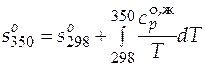 .
.
И при 298 К, и при 350 К этиленгликоль находится в одинаковом фазовом состоянии − жидком − т.е. в температурном интервале 298−350 К нет фазовых превращений. Мольная изобарная теплоемкость жидкого этиленгликоля в исследуемом температурном интервале постоянна и равна 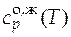 = 151,0 Дж/(моль×К).
= 151,0 Дж/(моль×К).
|
|
|
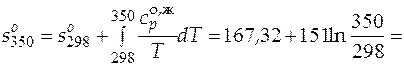 191,6 Дж/(моль×К).
191,6 Дж/(моль×К).
Пример 3. Чему равно изменение энтальпии при нагреве 1 моля этиленгликоля от 350 К до 500 К?
Решение. В указанный в условии диапазон температур попадает температура фазового превращения 479,4 К, следовательно, до этой температуры изменение энтальпии происходит за счет нагревания жидкости, затем следует изменение энтальпии при фазовом превращении, а далее изменение энтальпии связано с нагреванием газа. Расчет проводим по формуле (3.18), перейдя к мольным величинам, температурные зависимости теплоемкости нам известны. Мольную энтальпию фазового перехода находим в справочной литературе, она равна 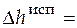 48,6×103 Дж/моль.
48,6×103 Дж/моль.
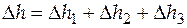 ;
;
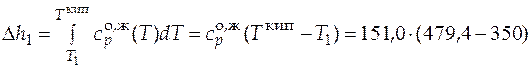 =
=
= 19 539,4 Дж/моль;
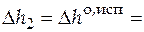 48,6×103 Дж/моль;
48,6×103 Дж/моль;
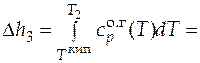
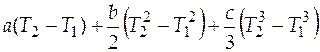 =
=
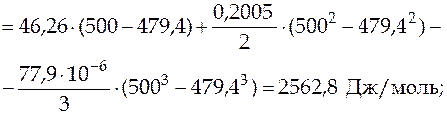
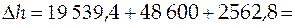 70 702,2 Дж/моль = 70,7 кДж/моль.
70 702,2 Дж/моль = 70,7 кДж/моль.
Пример 4. Вывести уравнение зависимости мольной энтропии от температуры для газообразного бензола при давлении 1 атм. Определить величину стандартной мольной изобарной теплоемкости бензола при 500 К двумя способами.
Решение. Зависимость мольной энтропии вещества от температуры можно найти после интегрирования выражений
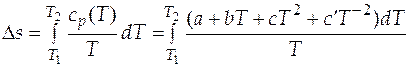 . (3.21)
. (3.21)
Слева в уравнении (3.21) стоит разность 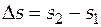 . Если в качестве первого состояния вещества выбрать его состояние при 298 К и 1 атм, то величину мольной энтропии (
. Если в качестве первого состояния вещества выбрать его состояние при 298 К и 1 атм, то величину мольной энтропии (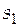 ) этого вещества легко найти в справочнике.
) этого вещества легко найти в справочнике.
Тогда из уравнения (3.21) имеем
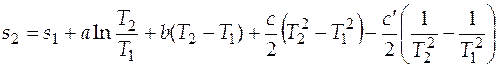 . (3.22)
. (3.22)
Уравнения (3.22) − это уже зависимость мольной энтропии от температуры, но её нужно обязательно преобразовать, учитывая, что известно числовое значение 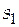 , а также значение Т 1 = 298 К. Необходимо учитывать, что уравнение (3.22) написано в общем виде, поэтому включает и эмпирический коэффициент
, а также значение Т 1 = 298 К. Необходимо учитывать, что уравнение (3.22) написано в общем виде, поэтому включает и эмпирический коэффициент 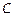 , и эмпирический коэффициент
, и эмпирический коэффициент 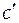 . Когда уравнение будет записано для конкретного вещества, тогда в зависимости от природы этого вещества в уравнении будет слагаемое или с коэффициентом
. Когда уравнение будет записано для конкретного вещества, тогда в зависимости от природы этого вещества в уравнении будет слагаемое или с коэффициентом 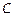 (для органических веществ), или с коэффициентом
(для органических веществ), или с коэффициентом 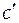 (для неорганических веществ).
(для неорганических веществ).
|
|
|
В рамках данной задачи имеем следующие данные:
| Вещество | 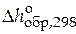 , кДж / моль , кДж / моль | 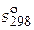 , Дж/(моль∙К) , Дж/(моль∙К) | Коэффициенты уравнения 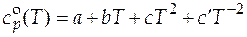 | |||
| а | 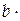 103 103 | 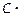 106 106 | 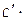 10−5 10−5 | |||
| C6H6 (г) бензол | 82,93 | 269,2 | -21,09 | 400,12 | -169,87 | - |
Следовательно, энтропия газообразного бензола при любой произвольной температуре Т
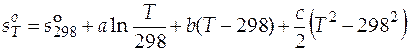 .
.
После подстановки числовых значений и преобразований имеем выражение температурной зависимости мольной энтропии газообразного бензола
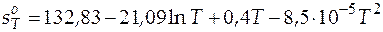 . (3.23)
. (3.23)
Используя уравнение (3.23), можно графически изобразить зависимость мольной энтропии газообразного бензола от температуры (рис. 3.1), а далее по этой зависимости определить величину изобарной теплоемкости бензола при температуре 500 К. Мольная изобарная теплоемкость связана с частной производной энтропии по температуре 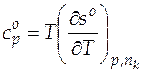 .
.

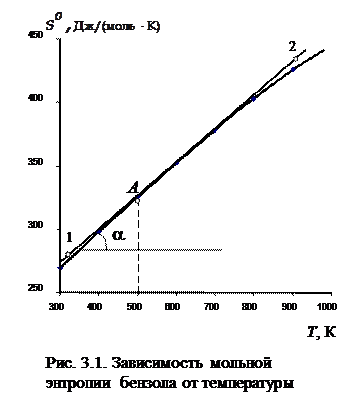 зависимости энтропии от температуры в точке, соответствующей 500 К. Графически производную находят, проводя к интересующей нас точке на кривой касательную, а затем определяя угловой коэффициент а этой касательной. Чтобы найти угловой коэффициент касательной, нужно взять на прямой две достаточно удаленные друг от друга точки и определить их координаты. Угловой коэффициент численно равен тангенсу угла наклона прямой (для рассматриваемого случая):
зависимости энтропии от температуры в точке, соответствующей 500 К. Графически производную находят, проводя к интересующей нас точке на кривой касательную, а затем определяя угловой коэффициент а этой касательной. Чтобы найти угловой коэффициент касательной, нужно взять на прямой две достаточно удаленные друг от друга точки и определить их координаты. Угловой коэффициент численно равен тангенсу угла наклона прямой (для рассматриваемого случая): 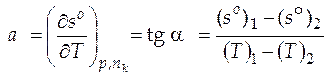 .
.
Затем находим изобарную теплоемкость 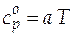 .
.
Из анализа рис. 3.1 видно, что зависимость энтропии от температуры имеет слабо выраженную кривизну, и если точек для построения кривой мало, то кажется, что такую зависимость можно описать прямой линией. Однако зависимость мольной энтропии от температуры − это все-таки кривая линия, и к ней можно провести касательную. Рекомендованный шаг по температуре для построения зависимости составляет 50 К. В случае если какой-то участок зависимости носит явно линейный характер, угловой коэффициент касательной будет совпадать с угловым коэффициентом самой линии.
Следующий способ определения мольной изобарной теплоемкости газообразного бензола расчетный, по формуле температурной зависимости изобарной теплоемкости, которая имеет вид:
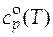 = −21,09 + 0,4 T − 0,000 169 Т 2 .
= −21,09 + 0,4 T − 0,000 169 Т 2 .
По этому способу мольная изобарная теплоемкость бензола при 500 К равна 136,66 Дж/(моль∙К). Значения теплоемкости, вычисленные разными способами, должны быть близки.
4. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
Для характеристики раствора применяют следующие виды концентраций.
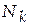 − мольная доля компонента k (часто – молярная доля),
− мольная доля компонента k (часто – молярная доля),
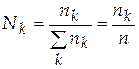 .
.
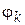 − массовая доля компонента,
− массовая доля компонента,
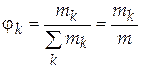 .
.
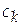 − молярная концентрация (c), другое название − плотность числа молей,
− молярная концентрация (c), другое название − плотность числа молей,
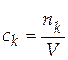 . [ c ] = моль/м3.
. [ c ] = моль/м3.
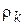 − массовая концентрация, другое название – плотность массы компонента k,
− массовая концентрация, другое название – плотность массы компонента k,
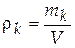 . [
. [ 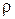 ] = кг/м3.
] = кг/м3.
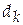 − моляльная концентрация раствора, или мольно-массовая концентрация, другое название – мольно-массовое отношение,
− моляльная концентрация раствора, или мольно-массовая концентрация, другое название – мольно-массовое отношение,
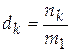 . [ d ] = моль/кг.
. [ d ] = моль/кг.
Состояние компонента k в растворе нельзя описать функциями, отвечающими чистому компоненту k. Для описания свойств компонента в растворе вводится понятие парциальных мольных свойств компонента. Если обозначить полное экстенсивное свойство раствора, образованного компонентами в общем виде, как 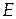 , то мольное экстенсивное свойство раствора, состоящего из компонентов k, будет обозначаться как
, то мольное экстенсивное свойство раствора, состоящего из компонентов k, будет обозначаться как 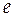 , причем
, причем 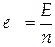 . Вклад компонента k в любое экстенсивное свойство E раствора определяется его парциальной мольной (ПМ) величиной
. Вклад компонента k в любое экстенсивное свойство E раствора определяется его парциальной мольной (ПМ) величиной 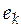 , которая равна
, которая равна
|
|
|
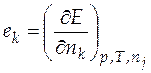 . (4.1)
. (4.1)
Следует отметить, что парциальные мольные величины отражают изменение свойств и их нельзя уподоблять соответствующим мольным величинам. Парциальные мольные величины могут принимать значения, которые немыслимы для мольных величин; например, парциальный мольный объем может быть отрицательным. Парциальные мольные величины могут быть образованы от любой экстенсивной величины. В общем случае экстенсивное свойство Е однородной системы, состоящей из k компонентов, можно представить в виде функции температуры, давления и чисел молей компонентов, т.е. 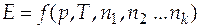 . Если зафиксировать постоянными давление и температуру, то получим
. Если зафиксировать постоянными давление и температуру, то получим 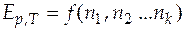 .
.
Образуем полный дифференциал этого выражения:
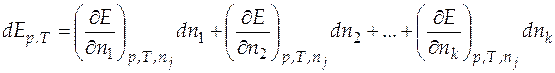 . (4.2)
. (4.2)
С учетом (4.1) из уравнения (4.2) можно получить
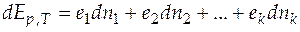
или 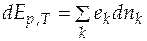 . (4.3)
. (4.3)
Учитывая, что E − однородная функция первой степени от независимых аргументов nk,и привлекая теорему Эйлера об однородных функциях, получаем из (4.3) выражение
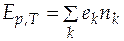 . (4.4)
. (4.4)
Если раствор двухкомпонентный, или как еще говорят, бинарный, т.е. число компонентов k = 2, то соотношения, получающиеся в этом случае, имеют вид:
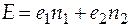 . (4.5)
. (4.5)
При делении выражения (4.5) на общее число молей получим
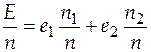 , (4.6)
, (4.6)
с учетом определительного выражения для мольной доли компонента k (4.6) можно записать как
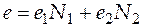 . (4.7)
. (4.7)
Используем эти же выражения для объема 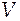 .
.
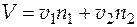 ,
,
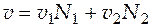 ,
,
где V – полный объем раствора; 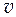 1 и
1 и 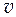 2- парциальные мольные объемы 1 и 2 компонентов раствора; n 1 и n 2 – числа молей компонентов 1 и 2; N 1 и N 2 – мольные доли компонентов 1 и 2 в растворе;
2- парциальные мольные объемы 1 и 2 компонентов раствора; n 1 и n 2 – числа молей компонентов 1 и 2; N 1 и N 2 – мольные доли компонентов 1 и 2 в растворе; 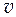 – мольный объем раствора.
– мольный объем раствора.
Способы определения парциальных мольных величин рассмотрим на примере определения парциальных мольных объемов в бинарном растворе.
Первый способ. Определение парциального мольного объема по зависимости полного объема раствора от числа молей одного из компонентов.
 Согласно определительному выражению для парциальной мольной величины (4.1), парциальный мольный (ПМ) объем второго компонента − это величина
Согласно определительному выражению для парциальной мольной величины (4.1), парциальный мольный (ПМ) объем второго компонента − это величина 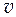 2 =
2 = 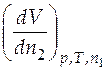 , а ПМ объем первого компонента − это
, а ПМ объем первого компонента − это 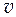 1 =
1 = 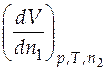 . Если известно уравнение зависимости, например
. Если известно уравнение зависимости, например 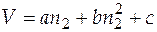 , то для получения
, то для получения 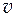 2 =
2 = 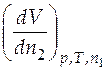 нужно продифференцировать его.Если зависимость дана в форме таблицы или в виде графика, то нужно определить угловой коэффициент касательной к кривой зависимости
нужно продифференцировать его.Если зависимость дана в форме таблицы или в виде графика, то нужно определить угловой коэффициент касательной к кривой зависимости 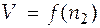 в той точке, в которой нам требуется определить ПМ объем. При графическом определении частной производной нужно найти угловой коэффициент касательной, проведенной к кривой зависимости в определенной точке (рис. 4.1).
в той точке, в которой нам требуется определить ПМ объем. При графическом определении частной производной нужно найти угловой коэффициент касательной, проведенной к кривой зависимости в определенной точке (рис. 4.1).
|
|
|
Рис. 4.1. Зависимость полного
объема раствора от числа молей
второго компонента (p,T, n 1 – const)
Частная производная полного объема по числу молей второго компонента в условиях постоянства давления, температуры и остального состава равна
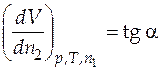 .
.
Угловой коэффициент касательной находится
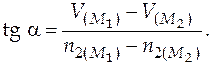
Второй способ. Определение ПМ объемов по зависимости мольного объема раствора от состава.
Парциальные мольные объемы компонентов бинарной смеси следующим образом связаны с мольным объемом смеси
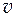 1 =
1 = 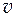 - N 2
- N 2 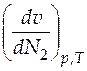 . (4.8)
. (4.8)
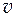 2 =
2 = 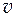 + (1 - N 2)
+ (1 - N 2) 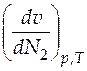 . (4.9)
. (4.9)
Из данных выражений следует, что для вычисления парциальных мольных объемов по этому методу необходимо по зависимости мольного объема от мольной доли второго компонента определить частную производную мольного объема раствора по мольной доле второго компонента при постоянных давлении и температуре 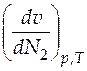 в интересующем нас растворе. Для определения производной, например, графическим способом, нужно к зависимости мольного объема раствора от состава (см. рис. 4.2, линия ВАС) в соответствующей точке провести касательную и определить угловой коэффициент этой касательной по координатам двух достаточно удаленных друг от друга точек, лежащих на касательной
в интересующем нас растворе. Для определения производной, например, графическим способом, нужно к зависимости мольного объема раствора от состава (см. рис. 4.2, линия ВАС) в соответствующей точке провести касательную и определить угловой коэффициент этой касательной по координатам двух достаточно удаленных друг от друга точек, лежащих на касательной
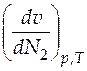
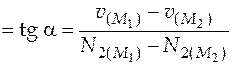 .
.
Далее по уравнениям (4.8) и (4.9) вычислить парциальные мольные объемы обоих компонентов.

Рис. 4.2. Зависимость мольного объема раствора от состава раствора
Третий способ. Определение ПМ объемов по методу Розебома
(метод отрезков).
Из анализа рис. 4.2 и уравнений (4.8−4.9) видно, что касательная к зависимости 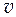 = f (N 2) отсекает на левой оси ординат отрезок, равный парциальному мольному объему первого компонента в растворе концентрации N 2, а на правой оси - отрезок, равный парциальному мольному объему второго компонента в растворе той же концентрации.
= f (N 2) отсекает на левой оси ординат отрезок, равный парциальному мольному объему первого компонента в растворе концентрации N 2, а на правой оси - отрезок, равный парциальному мольному объему второго компонента в растворе той же концентрации.
Примеры задач
Пример 1. Общее число молей в водно-ацетоновом растворе составляет 12,58 моль. Плотность массы раствора и плотность числа молей ацетона в нем равны соответственно 916 кг/м3 и 7897 моль/м3 при 298 К и 1 атм. Определить массу и объем раствора, его мольную массу и удельное число молей.
Дано: двухкомпонентный раствор. Компонент 1 – вода, H2O. Компонент 2 – ацетон, (CH3)2CO. M 1 = 0,018 кг/моль; M 2 = 0,058 кг/моль; n 2 = 12,58 моль; ρ = 918 кг/м3; c 2 = 7897 моль/м3.
Найти: m, V, M, n уд.
Решение. Решение основано на взаимосвязи между концентрационными шкалами.
Масса раствора: 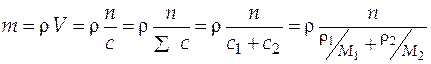 =
=
= 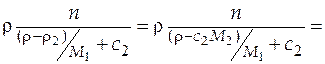
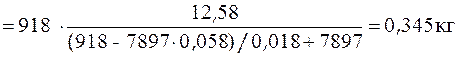 .
.
Объем раствора:
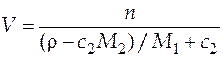 =
=
= 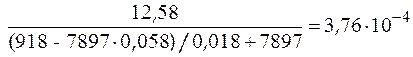 м3.
м3.
Мольная масса раствора:
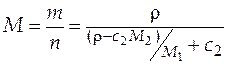 =
=
= 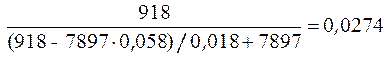 кг/моль.
кг/моль.
Удельное число молей раствора:
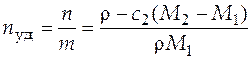 =
=
= 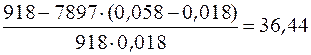 моль/кг.
моль/кг.
Пример 2. Для двухкомпонентного водно-аммиачного раствора приведена в табличной форме зависимость объема раствора от числа молей аммиака при постоянных параметрах: температуре 293 К, давлении 1 атм и числе молей воды 5,556 моль.
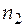 , моль , моль | 0,392 | 0,682 | 1,498 | 2,521 | |
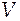 ·104, м3 ·104, м3 | 1,00 | 1,10 | 1,17 | 1,34 | 1,48 |
Вычислите парциальные мольные объемы обоих компонентов при мольной доле аммиака, равной 0,15.
Дано: двухкомпонентный раствор. Компонент 1 − вода, H2O.
M 1 = 0,018 кг/моль. Компонент 2 – аммиак, NH3. M 2 = 0,017 кг/моль. n 1= 5,556 моль. N 2 = 0,15. Найти: 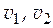 .
.
Решение. Изобразим графически данную в условии задачи зависимость объема системы от числа молей второго компонента.
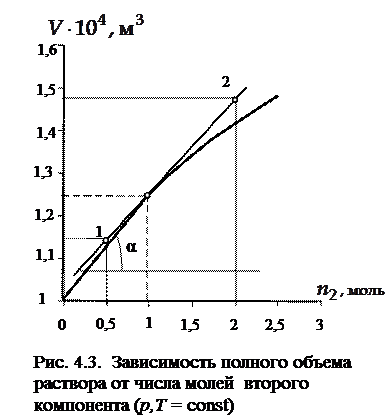 По определению парциальный мольный объем компонента 2 – это частная производная полного объема по числу молей второго компонента в условиях постоянства температуры, давления и числа молей первого компонента, т.е.
По определению парциальный мольный объем компонента 2 – это частная производная полного объема по числу молей второго компонента в условиях постоянства температуры, давления и числа молей первого компонента, т.е. 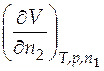 =
= 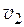 .
.
Полный объем бинарного раствора может быть найден как 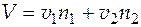 .
.
По рис. 4.3 найдем частную производную объема по числу молей второго компонента 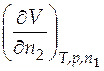 . Для этого определим угловой коэффициент касательной, проведенной к нашей зависимости в определенной точке. Данная точка должна показывать число молей второго компонента в растворе при мольной доле его, равной 0,15. Найдем значение n 2 из соотношения
. Для этого определим угловой коэффициент касательной, проведенной к нашей зависимости в определенной точке. Данная точка должна показывать число молей второго компонента в растворе при мольной доле его, равной 0,15. Найдем значение n 2 из соотношения
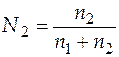 .
.
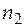 =
= 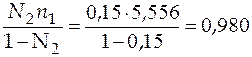 моль.
моль.
При числе молей второго компонента 0,98 восстанавливаем перпендикуляр к кривой и проводим к точке пересечения перпендикуляра с кривой касательную. Затем находим угловой коэффициент касательной
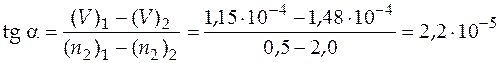 м3/моль,
м3/моль,
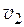 = 2,2×10 −5 м3/моль.
= 2,2×10 −5 м3/моль.
Примечание. Если зависимость полного объема от числа молей второго компонента представляет собой прямую линию, то касательная будет совпадать с ходом этой прямой.
Чтобы найти 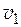 , воспользуемся соотношением
, воспользуемся соотношением 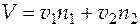 , причем значение полного объема системы при числе молей второго компонента, которое соответствует мольной доле его 0,15, определим по графику. V = 1,25×10 −4 м3.
, причем значение полного объема системы при числе молей второго компонента, которое соответствует мольной доле его 0,15, определим по графику. V = 1,25×10 −4 м3.
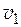 =
= 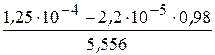 = 1,86×10−5 м3/моль.
= 1,86×10−5 м3/моль.
| N 2 | 0,0 | 0,255 | 0,424 | 0,617 | 0,870 | 1,000 |
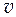 ∙105, м3/моль ∙105, м3/моль | 7,600 | 7,982 | 8,359 | 8,790 | 9,378 | 9,800 |
Пример 3. Для двухкомпонентного жидкого раствора ацетон (1-й компонент) - трихлорметан (2-й компонент) представлена в табличной форме (Т = 298 К, р = 1 атм) зависимость мольного объема раствора 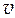 от мольной доли второго компонента N 2.
от мольной доли второго компонента N 2.
Определите для обоих компонентов парциальные мольные объемы 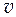 1 и
1 и 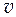 2 при мольной доле второго компонента N 2 = 0,6.
2 при мольной доле второго компонента N 2 = 0,6.
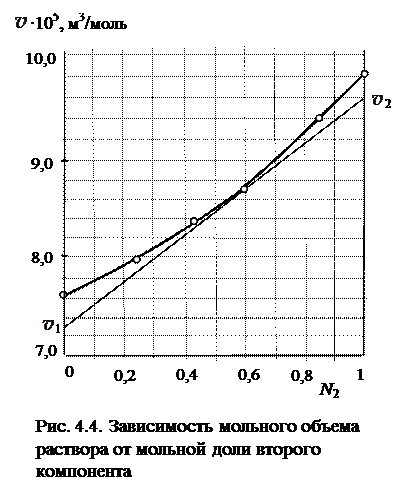 Решение. Изображаем данные, приведенные в условии задачи, в виде графической зависимости мольного объема от состава (мольная доля второго компонента). Проводим касательную к точке на кривой, при которой мольная доля трихлорметана (компонент 2) равна 0,6. Касательную проводим до пересечения с осями ординат и по величине, отсекаемой на каждой из осей, находим значения парциальных мольных объемов.
Решение. Изображаем данные, приведенные в условии задачи, в виде графической зависимости мольного объема от состава (мольная доля второго компонента). Проводим касательную к точке на кривой, при которой мольная доля трихлорметана (компонент 2) равна 0,6. Касательную проводим до пересечения с осями ординат и по величине, отсекаемой на каждой из осей, находим значения парциальных мольных объемов.
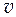 1 = 7,3∙10−5 м3/моль;
1 = 7,3∙10−5 м3/моль;
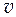 2 = 9,6∙10−5 м3/моль.
2 = 9,6∙10−5 м3/моль.
 2015-09-06
2015-09-06 5072
5072








