Пример 1. При гидрокрекинге н -додекана возможно протекание реакции C12H26 + H2 ⇄ 2 н -C6H14. Учитывая то, что все вещества газообразные, и то, что их свойства близки к свойствам идеальных газов, найти выражения зависимостей стандартных мольных энтропии и энтальпии реакции от температуры; стандартные мольные энтропию, энтальпию и энергию Гиббса реакции при температуре 900 К.
Решение. Расчет стандартных мольных энтальпии и энтропии реакции, протекающей при 298 К, производим по ранее приведенным формулам, используя значения стандартных мольных энтропий компонентов при 298 К и стандартных мольных энтальпий образования компонентов при 298 К. Эти величины находим в справочниках и формируем таблицу со справочными данными по всем компонентам этой реакции.
Таблица 5.1
Данные для расчета стандартных мольных энтропий и энтальпий реакции
| Вещество k | ν k | Стандартная мольная энтальпия образования вещества k, 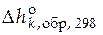 , кДж/моль , кДж/моль | Стандартная мольная энтропия вещества k, 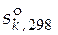 , Дж/(моль×К) , Дж/(моль×К) |
| C12H26 | -1 | - 286,69 | 622,54 |
| H2 | -1 | 0,0 | 130,52 |
| C6H14 | -167,19 | 388,40 |
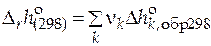 =
=
|
|
|
= (-1)×(-286,69) + (-1)×0 + 2×(-167,19) = -47,69 кДж/моль;
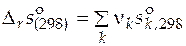 = (-1)×622,54 + (-1)×130,52 + 2×388,4 =
= (-1)×622,54 + (-1)×130,52 + 2×388,4 =
= 23,74 Дж/(моль×К).
Составляем еще одну таблицу исходных данных для расчета величин Δ ra, Δ rb, Δ rc, Δ rc'.
Таблица 5.2
Коэффициенты температурной зависимости теплоемкости
| Вещество k | ν k | 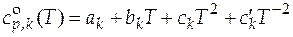 | |||
| ak | bk× 103 | ck× 106 | c'k× 10 -5 | ||
| C12H26 | -1 | 14,19 | 844,82 | 593,08 | 0,0 |
| H2 | -1 | 27,28 | 3,26 | 0,0 | 0,5 |
| C6H14 | 8,66 | 505,85 | -184,43 | 0,0 |
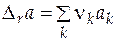 = (-1)∙14,19 +(-1)∙27,28 + 2×8,66 = -24,15 Дж/(моль×К);
= (-1)∙14,19 +(-1)∙27,28 + 2×8,66 = -24,15 Дж/(моль×К);
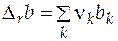 = (-1)∙0,84482 +(-1)∙0,00326 + 2×0,50585 = 0,16 362 Дж/(моль×К2);
= (-1)∙0,84482 +(-1)∙0,00326 + 2×0,50585 = 0,16 362 Дж/(моль×К2);
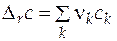 = (-1)∙5,931×10 -4+(-1)×0 + 2∙(-1,844×10 -4) =
= (-1)∙5,931×10 -4+(-1)×0 + 2∙(-1,844×10 -4) =
= -9,62×10-4Дж/(моль×К3);
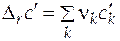 = (-1)×0 + (-1)∙50 000 + 2×0 = -50 000 Дж×К/моль.
= (-1)×0 + (-1)∙50 000 + 2×0 = -50 000 Дж×К/моль.
Найденные коэффициенты позволяют записать зависимость стандартной мольной изобарной теплоемкости реакции от температуры:
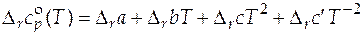 ;
;
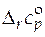 (T) = -24,15 + 0,1636 Т – 9,62×10 -4 Т 2 - 5×104 Т -2 Дж/(моль×К).
(T) = -24,15 + 0,1636 Т – 9,62×10 -4 Т 2 - 5×104 Т -2 Дж/(моль×К).
Именно эта зависимость в дальнейшем будет использоваться при интегрировании. По уравнению Кирхгофа:
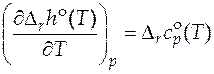 .
.
Разделим переменные и проинтегрируем:
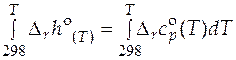 ;
;
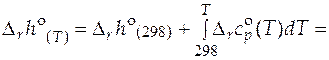
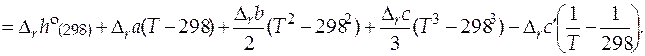
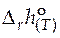 = -47 690 – 24,15(Т -298) +y 0,16 362 (Т 2 -2982) -
= -47 690 – 24,15(Т -298) +y 0,16 362 (Т 2 -2982) -
- 0,33×9,6192×10-4(Т 3 -2983) + 50 000 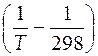 .
.
Проведя дальнейшие преобразования, получим температурную зависимость стандартной мольной энтальпии данной химической реакции:
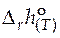 = - 39 440 - 24,15 Т + 0,08 181 Т 2 – 3,206×10 -4 Т 3 + 5×104 Т –1.
= - 39 440 - 24,15 Т + 0,08 181 Т 2 – 3,206×10 -4 Т 3 + 5×104 Т –1.
Стандартную мольную энтропию реакции при любой температуре 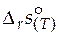 найдем после интегрирования соотношения
найдем после интегрирования соотношения
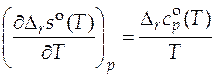 .
.
Разделим переменные и произведем интегрирование:
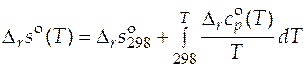 .
.
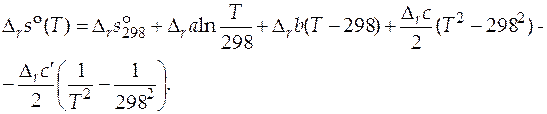
Подстановка значений температурной зависимости стандартной мольной изобарной теплоемкости реакции приводит к следующему виду уравнения
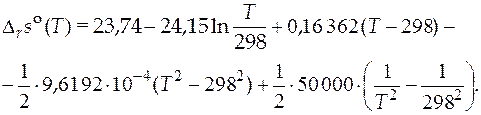
Проведя преобразования, находим температурную зависимость энтропии данной реакции
|
|
|
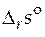 = 154,996 – 24,15 ln Т + 0,16 362 Т – 4,81×10-4 Т 2 + 25 000 Т -2.
= 154,996 – 24,15 ln Т + 0,16 362 Т – 4,81×10-4 Т 2 + 25 000 Т -2.
Воспользовавшись выведенными зависимостями стандартных мольных энтропии и энтальпии реакции от температуры, найдем значения этих функций, а также значение энергии Гиббса при 900 К.
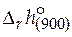 = - 39 440 - 24,15∙900 + 0,08 181 ∙ 9002 – 3,206×10 -4∙9003 +
= - 39 440 - 24,15∙900 + 0,08 181 ∙ 9002 – 3,206×10 -4∙9003 +
+5×104∙900 –1 = − 228 570 Дж/моль;
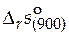 = 154,996 – 24,15ln 900+ 0,16 362 ∙900 – 4,81×10-4 ∙9002+
= 154,996 – 24,15ln 900+ 0,16 362 ∙900 – 4,81×10-4 ∙9002+
+25 000∙900 -2 = −251,57 Дж/(моль∙К);
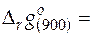
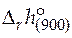 −
− 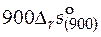 = −228 570 − 900∙(−251,57) =
= −228 570 − 900∙(−251,57) =
= −2157,0 Дж/моль.
Пример 2. Рассчитайте величину константы равновесия реакции, рассматриваемой в примере 1 и равновесный состав при температуре 900 К. В начальный момент времени в системе присутствуют по 1 молю н -додекана и водорода. Продуктов реакции в начальный момент времени нет.
Решение. Располагая данными о значении стандартной мольной энергии Гиббса реакции при 900 К, найдем по формуле (5.10) величину константы равновесия
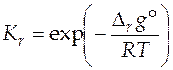 =
= 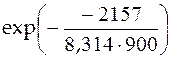 = 1,33.
= 1,33.
Формируем таблицу для дальнейшей работы. При этом вводим символьное обозначение реактантов, для составления балансовых соотношений руководствуемся формулой 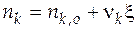 , а для определения мольных долей формулой
, а для определения мольных долей формулой 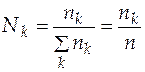 .
.
Таблица 5.3
Данные для составления закона равновесия
| Характеристики | Компонент | ||
| C12H26 (А) | H2 (В) | C6H14 (С) | |
Начальное число молей, 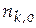 | |||
Число молей в момент равновесия, 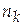 | 1- ξ | 1- ξ | 2ξ |
Суммарное число молей, 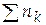 | 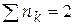 | ||
Равновесные мольные доли компонентов, 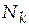 | 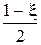 | 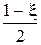 | ξ |
Закон химического равновесия для рассматриваемой реакции
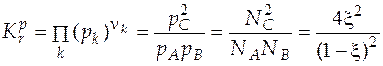 .
.
Решение квадратного уравнения относительно глубины химической реакции дает значение ξ = 0,266. Теперь легко определить состав в шкале мольных долей. Находим выражение для равновесных мольных долей компонентов и, располагая значениями глубины реакции, вычисляем их значения.
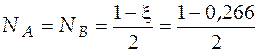 = 0,367;
= 0,367; 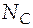 =
= 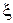 = 0,266.
= 0,266.
Примечание. В этом примере давление не входит в закон химического равновесия, однако для реакций, в которых число молекул исходных веществ в стехиометрическом уравнении не равно числу молекул продуктов, давление обязательно будет присутствовать в уравнении.
Пример 3. Реакция A + B = C + 2D протекает в газовой фазе. Составьте уравнение закона химического равновесия, если начальные количества веществ: 1) равны стехиометрическим коэффициентам, продуктов реакции в начальный момент нет; 2) не равны стехиометрическим коэффициентам. Рассчитайте равновесный состав смеси, если известно, что константа равновесия при температуре опыта равна 0,54 ([ p ] = 1 атм), начальные количества веществ равны 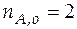 моль;
моль; 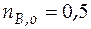 моль;
моль; 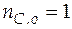 моль;
моль; 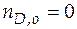 , а давление в системе 2 атм.
, а давление в системе 2 атм.
Решение. Для составления выражения закона химического равновесия в случае, когда начальные количества исходных веществ равны стехиометрическим коэффициентам, сформируем таблицу, в которой запишем балансовые соотношения и выражения для мольных долей участников реакции.
Таблица 5.4
Данные для составления закона равновесия
| Характеристики | Компонент | ||||
| А | В | С | D | ||
Начальное число молей, 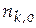 | |||||
Равновесное число молей, 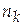 | 1- ξ | 1- ξ | ξ | 2ξ | |
Суммарное число молей, 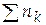 | 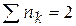 + ξ + ξ | ||||
Равновесные мольные доли компонентов, 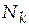 | 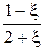 | 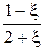 | 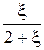 | 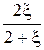 | |
Закон химического равновесия для рассматриваемой реакции и случая, когда начальный состав соответствует стехиометрическому,
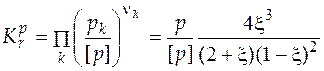 . (5.16)
. (5.16)
Решение уравнения (5.16) позволит определить равновесную глубину химической реакции и равновесный состав в мольных долях. Однако прежде чем будет рассмотрен метод вычисления равновесного состава по полученному закону химического равновесия, рассмотрим случай, когда в газовой смеси наблюдается нестехиометрическое соотношение между исходными веществами. Для составления закона химического равновесия сформируем таблицу, в которой запишем балансовые соотношения и выражения для мольных долей реактантов.
Таблица 5.5
Данные для составления закона равновесия
|
|
|
| Характеристики | Компонент | ||||||
| А | В | С | D | ||||
Начальное число молей 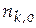 | 0,5 | ||||||
Равновесное число молей 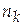 | 2- ξ | 0,5-ξ | 1+ ξ | 2ξ | |||
Суммарное число молей 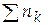 | 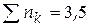 + ξ + ξ | ||||||
Равновесные мольные доли компонентов 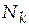 | 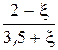 | 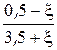 | 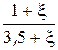 | 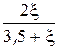 | |||
Выражение закона химического равновесия будет иметь вид
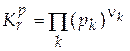
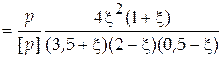 . (5.17)
. (5.17)
Уравнение (5.17) после подстановки в него данных из условия задачи примет вид:
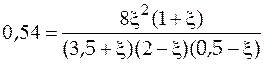 . (5.18)
. (5.18)
Подобные уравнения решают или методами последовательного приближения, или графически. Задавая в разумных пределах значение 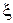 с некоторым шагом и вычисляя правую часть уравнения (5.18), можно получить графическую зависимость
с некоторым шагом и вычисляя правую часть уравнения (5.18), можно получить графическую зависимость 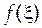 от ξ. Очевидно, что
от ξ. Очевидно, что 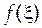 не может быть отрицательна, следовательно, в нашем примере
не может быть отрицательна, следовательно, в нашем примере 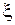 < 0,5. Несложные расчеты (не надо раскрывать скобки ни в числителе, ни в знаменателе!) приводят к следующим значениям:
< 0,5. Несложные расчеты (не надо раскрывать скобки ни в числителе, ни в знаменателе!) приводят к следующим значениям:
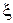 0,1 0,2 0,25 0,3 0,35
0,1 0,2 0,25 0,3 0,35
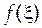 0,128 0,192 0,380 0,724 1,388
0,128 0,192 0,380 0,724 1,388
Наносим эти данные на график (рис. 5.1).
Если отметить на графике зависимости точку с ординатой 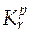 (соответствующей значению константы равновесия при исследуемой температуре), то решением уравнения (5.18) будет являться значение абсциссы этой точки.
(соответствующей значению константы равновесия при исследуемой температуре), то решением уравнения (5.18) будет являться значение абсциссы этой точки.
В общем случае на графике зависимости может быть несколько точек с заданной ординатой 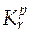 , все они являются решениями уравнения
, все они являются решениями уравнения 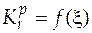 , и полученные значения
, и полученные значения 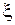 нуждаются в дополнительной проверке.
нуждаются в дополнительной проверке.
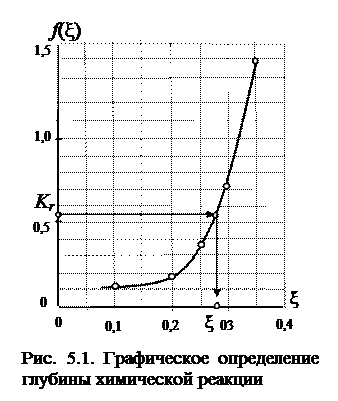 По графику определяем, что при f (ξ) =
По графику определяем, что при f (ξ) = 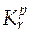 = 0,54 значение глубины химической реакции равно
= 0,54 значение глубины химической реакции равно 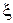 = 0,28.
= 0,28.
Равновесный состав смеси − это равновесные мольные доли всех компонентов. Подставляя полученное значение глубины реакции в выражения мольных долей компонентов, получаем:
NA = 0,455; NB = 0,058;
NC = 0,339; ND = 0,148.
Пример 4. Для реакции N2 + 3H2 = 2NH3, протекающей в газовой фазе при 298 К,константа равновесия при выражении давления в паскалях равна 6,0×105, а стандартная мольная энтальпия реакции равна –92,2 кДж./моль. Найти константу равновесия при 500 К.
Решение. Из интегральной формы уравнения изобары имеем
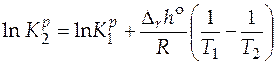 =
=
= 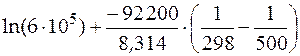 = –1,73,
= –1,73,
откуда 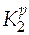 = 0,18.
= 0,18.
 2015-09-06
2015-09-06 1462
1462








