Расчеты изменений энтропии в различных процессах основаны на использовании неравенства Клаузиуса, которое связывает изменение энтропии 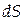 с количеством теплоты
с количеством теплоты 
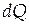 , которым система обменивается с окружающей средой при температуре
, которым система обменивается с окружающей средой при температуре 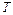
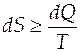 . (3.1)
. (3.1)
В данном случае знак равенства имеет место при обратимых, а неравенства – при необратимых процессах.
Величину энтропии данной системы нельзя измерить непосредственно на опыте, но ее можно вычислить, пользуясь формулой
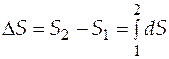 . (3.2)
. (3.2)
Эта формула позволяет найти не абсолютную величину энтропии, а разности энтропий в двух состояниях системы, т.е. изменение энтропии при переходе системы из состояния 1 в состояние 2.
Изменение энтропии при постоянном давлении можно найти интегрированием частной производной энтропии по температуре при постоянном давлении
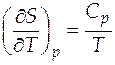 , (3.3)
, (3.3)
где 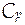 - изобарная теплоемкость системы, Дж/К.
- изобарная теплоемкость системы, Дж/К.
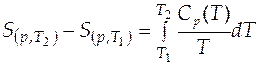 . (3.4)
. (3.4)
При решении уравнения (3.4) возможно два случая.
Случай 1. Теплоемкость вещества в интервале температур 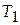 −
− 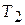 не зависит от температуры. Тогда после интегрирования (3.4) имеем:
не зависит от температуры. Тогда после интегрирования (3.4) имеем:
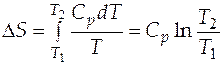 . (3.5)
. (3.5)
Случай 2. Теплоемкость является некоторой функцией температуры, например для мольной изобарной теплоемкости известны так называемые температурные ряды
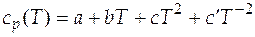 , (3.6)
, (3.6)
где 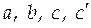 - эмпирически найденные коэффициенты. Их значения приводятся в справочной литературе.
- эмпирически найденные коэффициенты. Их значения приводятся в справочной литературе.
Подстановка выражения (3.6) в (3.4) позволяет после интегрирования получить следующее выражение
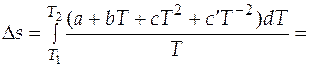
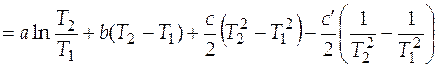 . (3.7)
. (3.7)
Разность энтропий в двух состояниях вычисляется просто, если обратимый переход из одного состояния в другое происходит при постоянной температуре. Это имеет место, например, при переходах из одного агрегатного состояния в другое, при фазовых переходах. Равновесные фазовые превращения (испарение, плавление, возгонка и т.д.) происходят в условиях постоянства температуры и давления. Они возможны только при подведении (или отводе) теплоты, затрачиваемой на проведения фазового превращения. Тогда формула (3.4) принимает вид
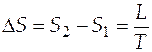 , (3.8)
, (3.8)
где 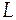 - скрытая теплота фазового превращения.
- скрытая теплота фазового превращения.
При постоянном давлении скрытая теплота превращения равна изменению энтальпии, т.е. например, для фазового превращения - испарения − формула (3.8) примет вид
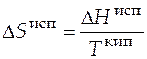 , (3.9)
, (3.9)
где 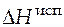 - энтальпия испарения, Дж;
- энтальпия испарения, Дж;
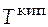 - температура кипения, К.
- температура кипения, К.
Если вещество в указанном диапазоне температур претерпевает фазовое превращение, то общее изменение энтропии будет складываться из нескольких слагаемых. Например, пусть некое условное вещество А переходит из твердого состояния при температуре 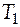 в жидкое состояние при температуре
в жидкое состояние при температуре 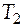 . Из условия задачи видно, что при определенной температуре имеет место фазовое превращение (фазовый переход) - плавление. Находим в справочнике эту температуру, обозначим ее в общем виде
. Из условия задачи видно, что при определенной температуре имеет место фазовое превращение (фазовый переход) - плавление. Находим в справочнике эту температуру, обозначим ее в общем виде 
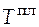 . Общее изменение энтропии будет равно сумме трех слагаемых (так называемых вкладов).
. Общее изменение энтропии будет равно сумме трех слагаемых (так называемых вкладов).
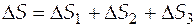 . (3.10)
. (3.10)
Первый вклад в общее изменение энтропии - это изменение энтропии при нагреве твердого вещества от температуры 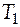 до температуры плавления
до температуры плавления
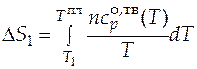 . (3.11)
. (3.11)
При температуре плавления твердое состояние переходит в жидкое, при этом наблюдается изменение энтропии. Изменение энтропии при фазовом превращении:
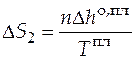 . (3.12)
. (3.12)
И, наконец, последний вклад в общее изменение энтропии внесет изменение энтропии при дальнейшем нагреве уже образовавшейся жидкости от температуры плавления до температуры 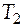
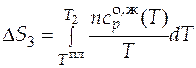 . (3.13)
. (3.13)
Абсолютная мольная энтропия газообразного вещества в стандартном состоянии при температуре Т может быть найдена как сумма изменений мольной энтропии в следующих процессах: нагрев исследуемого вещества в твердом состоянии от нуля до температуры плавления; процесс плавления; нагрев жидкого вещества до температуры кипения; испарение жидкости; нагрев полученного газообразного вещества до нужной температуры.
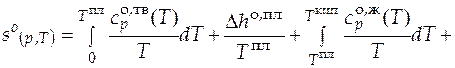
+ 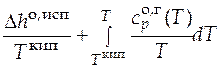 . (3.14)
. (3.14)
В справочных термодинамических таблицах обычно приводят значения абсолютной энтропии в стандартном состоянии при температуре 298 К 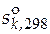 . Тогда расчет абсолютного значения энтропии при какой-либо другой температуре можно произвести исходя из значения энтропии при 298 К, используя формулу (3.14) и учитывая агрегатное состояние исследуемого вещества при 298 К.
. Тогда расчет абсолютного значения энтропии при какой-либо другой температуре можно произвести исходя из значения энтропии при 298 К, используя формулу (3.14) и учитывая агрегатное состояние исследуемого вещества при 298 К.
Для расчета изменения энтальпии системы, в которой нет химической реакции, а только происходит изменение температуры, например, при постоянном давлении, воспользуемся определительным выражением изобарной теплоемкости
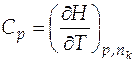 , отсюда
, отсюда 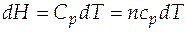 . (3.15)
. (3.15)
Так же как и при расчете энтропии, тут возможно два случая.
Случай 1. Теплоемкость вещества в интервале температур 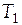 −
− 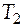 не зависит от температуры. Тогда после интегрирования (3.15) имеем:
не зависит от температуры. Тогда после интегрирования (3.15) имеем:
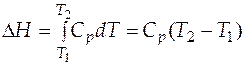 . (3.16)
. (3.16)
Случай 2. Теплоемкость является некоторой функцией температуры. Подстановка выражения (3.6) в (3.16) позволяет после интегрирования получить следующее выражение
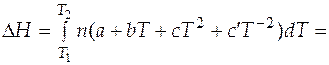
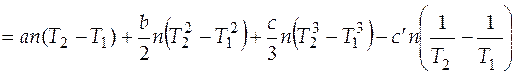 . (3.17)
. (3.17)
Если в указанном диапазоне температур возможно фазовое превращение, как это было рассмотрено в вышеприведенном примере с нагревом твердого вещества А, то все изменение энтальпии  будет равно сумме
будет равно сумме
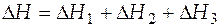 , (3.18)
, (3.18)
где 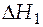 - вклад в общее изменение энтальпии за счет процесса нагрева твердого вещества от температуры
- вклад в общее изменение энтальпии за счет процесса нагрева твердого вещества от температуры 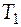 до температуры плавления
до температуры плавления
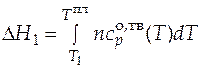 , (3.19)
, (3.19)
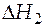 - изменение энтальпии за счет фазового превращения, это энтальпия фазового перехода, находится в справочниках;
- изменение энтальпии за счет фазового превращения, это энтальпия фазового перехода, находится в справочниках;
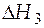 - изменение энтальпии за счет дальнейшего нагрева системы от температуры фазового перехода до нужной температуры. Очевидно, что форма уравнения для расчета
- изменение энтальпии за счет дальнейшего нагрева системы от температуры фазового перехода до нужной температуры. Очевидно, что форма уравнения для расчета 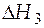 будет аналогичной (3.19), только коэффициенты температурного ряда теплоемкости нужно брать для жидкого вещества А.
будет аналогичной (3.19), только коэффициенты температурного ряда теплоемкости нужно брать для жидкого вещества А.
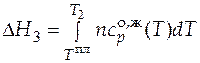 .
.
Для расчета изменения энергии Гиббса чистого вещества при переходе его из состояния I в состояние II удобно использовать расчетную формулу:
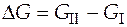 . (3.20)
. (3.20)
Более подробно расчет изменения энергии Гиббса будет рассмотрен при решении задачи.
 2015-09-06
2015-09-06 663
663








