В данном разделе разбираются задачи, в которых число компонентов k равно двум во всех точках диаграмм состояния, кроме точек на осях чистых компонентов или осях, соответствующих химическим соединениям. При решении задач нужно помнить, что условия фазового равновесия − это равенство температуры и давления во всех фазах, находящихся в равновесии, и равенство химических потенциалов компонентов в каждой из фаз.
Пример 2. По изобарической диаграмме состояния (диаграмме кипения) системы ацетон (компонент А) − сероуглерод (компонент В) (см. рис. 6.2) выполните следующие задания:
1) проведите анализ фазового состояния системы;
2) проанализируйте процесс нагревания системы первоначального состава, характеризуемо точкой а, от температуры 312 К до температуры 328 К;
3) определите мольную массу системы, общее число молей и число молей каждого компонента в точке а, если известно, что масса системы 1 кг;
4) определите массы компонентов в жидком и парообразном состоянии в системе массой 1 кг, характеризуемой точкой d;
5) определите, какой компонент и в каком количестве нужно добавить к 1 кг системы, находящейся при температуре 320 К в точке d, чтобы система стала гомогенной (при этой же температуре).
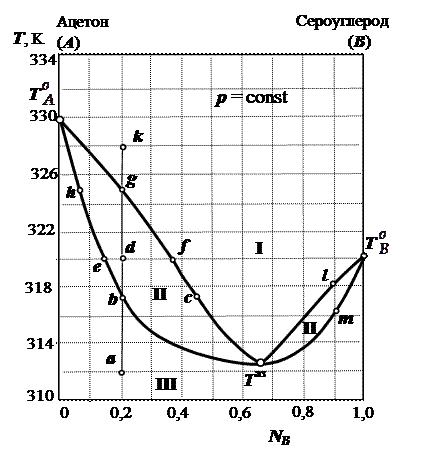 Рис. 6.2. Диаграмма
Рис. 6.2. Диаграмма
кипения системы
ацетон−сероуглерод
Решение
1. Линии на диаграмме кипения: линия 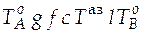 − кривая зависимости состава насыщенного пара от температуры; линия
− кривая зависимости состава насыщенного пара от температуры; линия 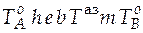 − кривая зависимости состава кипящей жидкости от температуры.
− кривая зависимости состава кипящей жидкости от температуры.
Гомогенные области: область I − пар, область III − жидкость.
Гетерогенная область − область II − жидкость + пар.
Особые точки: 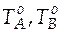 − температуры кипения чистого вещества А и чистого вещества В.
− температуры кипения чистого вещества А и чистого вещества В.
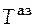 − температура кипения азеотропной смеси, состав азеотропной смеси
− температура кипения азеотропной смеси, состав азеотропной смеси 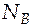 = 0,66;
= 0,66; 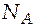 = 0,34.
= 0,34.
2. При нагревании системы от точки а до точки b система гомогенна, это жидкость. В точке b (при температуре 317,3 К) начинается кипение. В точке b кипящая жидкость находится в равновесии с паром. Состав первых порций пара соответствует точке с, т.е. 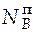 = 0,45. При сравнении состава жидкости и пара, находящихся при одной температуре, видно, что пар обогащен сероуглеродом (компонент В). Естественно, что жидкость будет обедняться сероуглеродом и температура кипения жидкости изменяется от точки b до точки h. Следовательно, температура кипения первоначальной смеси (состав точки а) меняется c 317,3 К до 325 К. Последняя капля жидкости исчезнет при 325 К, причем её состав будет соответствовать точке h, а состав равновесного с этой жидкостью пара (т.е. находящегося при такой же температуре, что и жидкость) будет соответствовать точке g. Выше точки g система будет опять гомогенна − это пар.
= 0,45. При сравнении состава жидкости и пара, находящихся при одной температуре, видно, что пар обогащен сероуглеродом (компонент В). Естественно, что жидкость будет обедняться сероуглеродом и температура кипения жидкости изменяется от точки b до точки h. Следовательно, температура кипения первоначальной смеси (состав точки а) меняется c 317,3 К до 325 К. Последняя капля жидкости исчезнет при 325 К, причем её состав будет соответствовать точке h, а состав равновесного с этой жидкостью пара (т.е. находящегося при такой же температуре, что и жидкость) будет соответствовать точке g. Выше точки g система будет опять гомогенна − это пар.
3. Точка а характеризуется следующими параметрами:
температура 312 К, состав системы 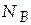 = 0,2.
= 0,2.
Мольная масса системы в этой точке находится по формуле:
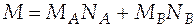 = 0,8∙0,058 + 0,2∙0,076 = 0,0616 кг/моль.
= 0,8∙0,058 + 0,2∙0,076 = 0,0616 кг/моль.
Общее число молей определяется как
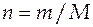 = 1/0,0616 = 16,234 моль.
= 1/0,0616 = 16,234 моль.
Известно, что 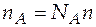 и
и 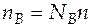 ,
,
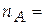 0,8∙16,234 = 12,987 моль;
0,8∙16,234 = 12,987 моль; 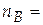 0,2∙16,234 = 3,247 моль.
0,2∙16,234 = 3,247 моль.
4. В точке d система гетерогенна: она состоит из жидкой фазы и пара. Состав жидкой фазы соответствует точке e, а состав паровой фазы − точке f.
Воспользуемся данными диаграммы кипения, и определим составы равновесных фаз, соответствующих точке d. Для этой точки 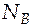 = 0,2;
= 0,2; 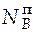 = 0,37;
= 0,37; 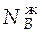 = 0,15.
= 0,15.
По правилу рычага
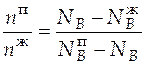 =
= 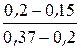 = 0,294.
= 0,294.
Общее число молей в системе 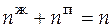 = 16,234 моль. Отсюда, решая систему, находим
= 16,234 моль. Отсюда, решая систему, находим 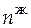 = 12,545 моль;
= 12,545 моль; 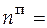 3,688 моль.
3,688 моль.
Это общее количество молей в жидкой и паровой фазах. Найдем число молей каждого компонента в разных фазах.
Состав жидкой фазы соответствует точке e, т.е.
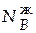 = 0,15;
= 0,15; 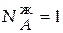 −
− 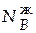 = 0,85.
= 0,85.
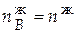
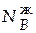 = 12,545∙0,15 = 1,882 моль;
= 12,545∙0,15 = 1,882 моль;
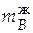 =
= 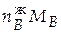 = 1,882∙0,076 = 0,143 кг.
= 1,882∙0,076 = 0,143 кг.
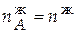
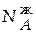 = 12,545∙0,85 = 10,663 моль;
= 12,545∙0,85 = 10,663 моль;
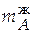 =
= 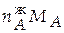 = 10,663∙0,058 = 0,618кг.
= 10,663∙0,058 = 0,618кг.
Состав паровой фазы соответствует точке f, т.е. 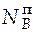 = 0,37;
= 0,37; 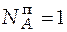 −
− 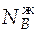 = 0,63.
= 0,63.
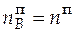
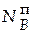 = 3,688∙0,37 = 1,364 моль;
= 3,688∙0,37 = 1,364 моль;
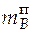 =
= 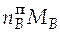 = 1,364∙0,076 = 0,104 кг.
= 1,364∙0,076 = 0,104 кг.
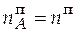
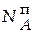 = 3,688∙0,63 = 2,324 моль;
= 3,688∙0,63 = 2,324 моль;
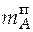 =
= 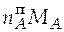 = 2,325∙0,058 = 0,135 кг.
= 2,325∙0,058 = 0,135 кг.
5. Систему, находящуюся в состоянии, характеризуемом точкой d, можно перевести в две гомогенные области: либо в жидкость, либо в пар. Следует отметить, что при этом мы будем нарушать существующее равновесие, описываемое данной диаграммой кипения, т.к. мы будем добавлять в систему определенное количество какого-либо компонента. Один из методов расчета – метод неизменного компонента. Рассмотрим случай, когда систему переводят в жидкость. Очевидно, что при таком переводе в нее нужно будет добавлять ацетон. Поскольку данный перевод осуществляется при постоянной температуре, равной 320 К, то, воспользовавшись диаграммой кипения, найдем, чему будут равны мольные доли обоих компонентов при такой температуре, если это будет жидкая фаза.
Состояние новой системы (с добавленным ацетоном) можно охарактеризовать новым положением на диаграмме чуть левее точки e, т.е. 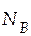 = 0,15, а
= 0,15, а 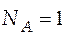 −
− 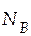 = 0,85. Как было отмечено ранее, добавлять в систему нужно ацетон. При этом сероуглерод добавлять не нужно, значит, количество сероуглерода останется таким же, каким было в точке d.
= 0,85. Как было отмечено ранее, добавлять в систему нужно ацетон. При этом сероуглерод добавлять не нужно, значит, количество сероуглерода останется таким же, каким было в точке d.
В точке d: 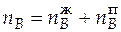 = 1,882 + 1,364 = 3,246 моль. Это количество сероуглерода будет соответствовать
= 1,882 + 1,364 = 3,246 моль. Это количество сероуглерода будет соответствовать 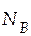 = 0,15 в новой системе (с добавленным ацетоном). Составляем пропорцию:
= 0,15 в новой системе (с добавленным ацетоном). Составляем пропорцию:
3,246 моль CS2 − 0,15
X моль (CH3)2CO − 0,85.
Находим количество ацетона в новой системе
X = 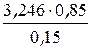 = 18,394 моль.
= 18,394 моль.
Чтобы ответить на вопрос задачи, т.е. узнать, сколько нужно добавить ацетона, из количества ацетона в новой системе вычтем количество ацетона в системе, характеризуемой точкой d.
В точке d: 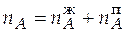 = 10,663 + 2,324 = 12,987 моль.
= 10,663 + 2,324 = 12,987 моль.
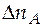 = 18,394 − 12,987 = 5,407 моль.
= 18,394 − 12,987 = 5,407 моль.
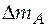 =
= 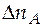 MA = 5,407 ∙ 0,058 = 0,314 кг.
MA = 5,407 ∙ 0,058 = 0,314 кг.
 2015-09-06
2015-09-06 3088
3088








