Усяка термодинамічна система в будь-якому стані має деяку повну енергію 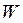 , що містить у собі:
, що містить у собі:
1) кінетичну енергію механічного руху всієї системи як цілого або її макроскопічних частин;
2) потенціальну енергію, що залежить від положення системи у зовнішньому силовому полі (гравітаційному, електричному);
3) внутрішню енергію 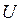 , що залежить тільки від внутрішнього стану системи. У термодинаміці зазвичай розглядають макроскопічні умовно нерухомі системи, не враховуючи їх потенціальну енергію у зовнішніх силових полях. Для абстрагованих у такий спосіб систем значення повної і внутрішньої енергії співпадають. Тому поняття внутрішньої енергії є одним з основних у термодинаміці. До складу внутрішньої енергії входить енергія усіх видів руху і взаємодії усіх частинок (атомів, молекул, іонів, електронів тощо), що утворюють дослідну систему. Так наприклад, у внутрішню енергію газоподібного тіла входять:
, що залежить тільки від внутрішнього стану системи. У термодинаміці зазвичай розглядають макроскопічні умовно нерухомі системи, не враховуючи їх потенціальну енергію у зовнішніх силових полях. Для абстрагованих у такий спосіб систем значення повної і внутрішньої енергії співпадають. Тому поняття внутрішньої енергії є одним з основних у термодинаміці. До складу внутрішньої енергії входить енергія усіх видів руху і взаємодії усіх частинок (атомів, молекул, іонів, електронів тощо), що утворюють дослідну систему. Так наприклад, у внутрішню енергію газоподібного тіла входять:
а) кінетична енергія хаотичного (теплового) поступального й обертального рухів молекул;
б) кінетична і потенціальна енергія коливань атомів у молекулах;
в) потенціальна енергія, зумовлена силами міжмолекулярної взаємодії;
г) енергія взаємодії електронів в атомах і молекулах між собою і ядрами;
д) енергія руху і взаємодії нуклонів у ядрах.
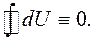 Зміна внутрішньої енергії при переході з деякого стану 1 у стан 2 не залежить від виду процесу переходу, а залежить тільки від початкового і кінцевого станів цієї системи. Зокрема, якщо в результаті будь-якого процесу система повертається у вихідний стан, то повна зміна її внутрішньої енергії дорівнює нулю:
Зміна внутрішньої енергії при переході з деякого стану 1 у стан 2 не залежить від виду процесу переходу, а залежить тільки від початкового і кінцевого станів цієї системи. Зокрема, якщо в результаті будь-якого процесу система повертається у вихідний стан, то повна зміна її внутрішньої енергії дорівнює нулю:
(2.1)
Зміна внутрішньої енергії 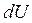 є повним диференціалом термодинамічних координат, а внутрішня енергія системи є однозначною функцією термодинамічного стану системи.
є повним диференціалом термодинамічних координат, а внутрішня енергія системи є однозначною функцією термодинамічного стану системи.
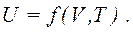 Внутрішня енергія системи у стані термодинамічної рівноваги залежить тільки від температури і зовнішніх параметрів системи. Наприклад, внутрішня енергія
Внутрішня енергія системи у стані термодинамічної рівноваги залежить тільки від температури і зовнішніх параметрів системи. Наприклад, внутрішня енергія 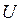 системи постійної маси m залежить від температури Т іоб'єму V системи:
системи постійної маси m залежить від температури Т іоб'єму V системи:
(2.2)
Внутрішня енергія, подібно до потенціальної енергії в механіці, може бути визначена тільки з точністю до деякої постійної 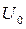 , що залежить від вибору стану, в якому внутрішню енергію системи приймають рівною нулю. Однак це несуттєво, тому що в термодинаміці визначають не абсолютні значення внутрішньої енергії
, що залежить від вибору стану, в якому внутрішню енергію системи приймають рівною нулю. Однак це несуттєво, тому що в термодинаміці визначають не абсолютні значення внутрішньої енергії 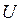 , а лише її зміну в розглянутих процесах. Тому в термодинаміці під внутрішньою енергією розуміють тільки ті її складові, що змінюються в розглянутих термодинамічних процесах. Враховуючи це, під внутрішньою енергією реального газу можна розуміти складові а), б) і в), а під внутрішньою енергією ідеального газу – складову а), як повну внутрішню енергію газоподібного тіла.
, а лише її зміну в розглянутих процесах. Тому в термодинаміці під внутрішньою енергією розуміють тільки ті її складові, що змінюються в розглянутих термодинамічних процесах. Враховуючи це, під внутрішньою енергією реального газу можна розуміти складові а), б) і в), а під внутрішньою енергією ідеального газу – складову а), як повну внутрішню енергію газоподібного тіла.
 2015-09-06
2015-09-06 1422
1422








