Для генетичних і фізіологічних досліджень, а також для практичного використання в клітинній селекції використовують ізольовані клітини. Отримання клону-потомства одиночної клітини допомагає з’ясувати причини генетичної неоднорідності калюсних клітин, оскільки спостереження в цьому випадку проводяться на тканині, яку отримали не з гетерогенного експлантата, а з однієї клітини. Ізольовані клітини також використовують як модель для вивчення взаємовідношень між клітиною і оточуючим середовищем, клітинами рослини-хазяїна і різними патогенними мікроорганізмами тощо.
Отримання одноклітинних клонів рослин складається з двох етапів:
1. виділення одиночних життєздатних клітин;
2. створення сприятливих умов для їх поділу і росту.
Для виділення життєздатних культур використовують такі методи:
1. вирощування калюсної маси і отримання із неї суспензії;
2. слабо агреговані суспензії;
3. виділення окремих клітин із тканин цілої рослини.
Отримання клітин із суспензійних культур пов’язане з меншим ризиком пошкодження порівняно з виділенням безпосередньо із органів рослини. Для отримання одноклітинної фракції суспензійної культури іноді достатньо простого відстоювання у колбі протягом 15-30 хв. При цьому крупні агрегати осідають на дно колби, а надосадова фракція містить тільки одинокі клітини або дрібні агрегати. Якщо при відстоюванні не вдається отримати одноклітинну фракцію, то застосовують ферменти для мацерації, центрифугування в градієнті сахарози або фільтрування через сита (нейлонові або металеві).
Труднощі культивування одиночних клітин пов’язані з тим, що окрема клітина не ділиться в тих умовах, в яких добре росте калюсна тканина. Для того, щоб змусити одиночні клітини ділитися, розроблені спеціальні методи:
1. метод культури “няньки”;
2. метод мікрокультури або висячих крапель;
3. метод плейтінга.
Сюди можна віднести і культуру ізольованих протопластів, яку буде розглянуто далі.
Метод культури “няньки” запропонував Джонсон у 1960 році. Функцію “няньки”, яка стимулює поділ одиночної клітини, виконують шматочки калюсної тканини, відокремлені від неї фільтрувальним папером. У присутності “няньки” одиночна клітина ділиться і дає індивідуальну колонію клітин – клон (Рис. 2).
Метод мікрокультури базується на використанні дуже малих об’ємів багатого живильного середовища і являє собою культивування одиночних клітин в мікрокраплі в чашці Купрака об’ємом 20 мл. Метод запропонував
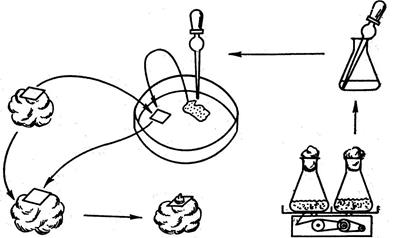
Рис.2. Метод культури “няньки” для вирощування культури із одиночної клітини.
академік Глєба Ю.Ю. У мікрокраплях зручно спостерігати за отриманням і діленням клітин при соматичній гібридизації.
Метод плейтінга передбачає змішування клітин суспензії з розплавленим та охолодженим до 35°–40° С середовищем і розлив тонким шаром (1 мм) у чашки Петрі. Цей метод був розроблений Бергманом у 1960 році. Цей метод використовують для отримання одноклітинних клонів та оцінки життєздатності клітин.
Використання культури “няньки”, мінімального об’єму середовища, в якому культивується окрема клітина, пов’язані з феноменом, який називають
“дія фактора кондиціонування”. Незважаючи на численні спроби визначити хімічну природу речовин (або речовини), які індукують ділення одиночної клітини, і механізм дії фактора кондиціонування, ця проблема залишається не вирішеною. Дослідження показали, що цей фактор хімічної природи і включає низькомолекулярні речовини (~700 Д).
Методи оцінки результатів
Для характеристики росту культур in vitro в першу чергу визначають збільшення сирої маси (Wt–Wo). Результати можуть бути виражені відносно вихідної маси 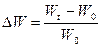 . Це дозволяє встановити у скільки разів збільшилася маса протягом досліду. Величину приросту маси можна виразити у відсотках
. Це дозволяє встановити у скільки разів збільшилася маса протягом досліду. Величину приросту маси можна виразити у відсотках 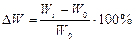 . Якщо тривалість росту в окремих випадках неоднакова, необхідно ввести у формулу фактор часу
. Якщо тривалість росту в окремих випадках неоднакова, необхідно ввести у формулу фактор часу 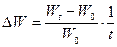 .
.
Таким же чином можна проводити облік результатів за масою сухої речовини.
Більше інформації про характер росту культури отримують при визначенні числа клітин на одиницю маси тканини. Підрахунок клітин дозволяє визначити збільшення маси тканини відбувається за рахунок поділу клітин чи їх росту. Це дає можливість розрахувати і середню вагу клітини. Кількість клітин визначають за методом розробленим Брауном, який полягає у мацерації і послідуючому підрахунку краплі суспензії клітин у лічильній камері під мікроскопом. Використовують кілька методів мацерації. Більшість з них базується на обробці тканин сильними кислотами, які гідролізують серединні пластинки, що з’єднують клітини.
Для суспензійних культур визначають об’єм ущільнених клітин. Для цього в градуйовані центрифужні пробірки переносять певний об’єм суспензії (15 – 30 мл) і центрифугують при 1500g 10 хв або суспензію поміщають в градуйований циліндр і відстоюють впродовж доби. Об’єм ущільнених клітин виражають в мл клітинного осаду на мл культури.
Розмір клітин визначають вимірюючи їхню довжину та ширину під мікроскопом за допомогою шкали окуляр-мікрометра та об’єкт мікрометра.
Контрольні запитання і завдання
1. Що таке калюс?
2. Які зміни відбуваються у спеціалізований клітині при переході до дедиференціації?
3. Із яких органів рослини можна отримати калюсну тканину?
4. Яка основна особливість середовища для калюсогенезу у злаків?
5. Назвіть типи калюсної тканини.
6. Яке практичне використання пухких калюсів?
7. Який тип калюсної тканини Ви б використали для отримання рослин-регенерантів?
8. Наведіть приклади можливого використання калюсної тканини.
9. Що таке клітинна суспензія та яке її практичне значення?
10. Калюсній тканині якого типу надається перевага для отримання клітинної суспензії?
11. Назвіть методи культивування одиночних клітин.
12. Які показники визначають для оцінки росту суспензійної культури?
 2015-09-06
2015-09-06 1796
1796








