Біотехнологія рослин найширше використовується у агротехніці для прискореного розмноження і оздоровлення цінних сортів сільськогосподарських культур. На основі цієї технології створена ціла індустрія мікроклонального розмноження рослин.
Мікроклональне розмноження - це безстатеве вегетативне розмноження в культурі in vitro, при якому отримують рослини генетично ідентичні вихідній батьківській формі, що сприяє збереженню генетично однорідного посадкового матеріалу. Цим методом можна розмножувати у короткі строки види, які важко розмножуються і рослини, які є в одному екземплярі, а також і стерильні генотипи. Особливої актуальності сьогодні набули дослідження по розробці методів мікроклонального розмноження рідкісних та зникаючих рослин. Багаточисельність, швидкість і високий коефіцієнт розмноження (1:1 000 000) дозволяє у 2–3 рази скоротити термін відбору і отримання нових рослин у селекційних дослідженнях.
Мікроклональне розмноження має цілий ряд переваг над традиційними методами розмноження рослин:
1) економія вихідного матеріалу;
2) отримання великого числа копій із мінімальної кількості рослинного матеріалу;
3) отримання генетично однорідного матеріалу;
4) можливість відбирати in vitro рослинний матеріал з бажаними ознаками;
5) можливість отримання безвірусного матеріалу;
6) можливість проводити розмноження рослин протягом цілого року, адже їх ріст і розвиток in vitro практично не залежать від сезону;
7) можливість отримувати у великих кількостях вегетативне потомство видів рослин, що важко розмножуються у звичайних умовах;
8) економія площі;
9) можливість тривалого збереження пробірочних рослин при понижених температурах, що дає змогу створити банк цінних форм рослин.
Теорією і принципом розробки технології мікроклонального розмноження є положення про можливість індукції диференціації і органогенезу, виникнення біологічної форми із однієї рослинної клітини, її здатності утворювати цілу рослину. Клітина in vivo у складі тканини з певною диференціацією виконує вузьку специфічну функцію. Реалізація її тотипотентності in vivo послаблюється факторами і умовами, які мають місце на материнській рослині. Якщо ж клітина вилучається із рослини і поміщається у штучні контрольовані умови in vitro, то реалізується потенційна можливість відновлення рослини із клітини або групи клітин, тобто реалізується властива клітині тотипотентність. Прояв цієї властивості поки що виявлено у клітин, які називаються меристемоїдами.
Меристемоїди – це морфогенетично компетентні клітини, які відповідають на індуктори диференціації і склад середовищ формуванням пагонів, коренів, зародка. Морфологічно їх виявляють у калюсних культурах у компактних осередках клітин, що діляться, у вигляді дрібних, ізодіаметричних, тонкостінних клітин з великим ядром, густою цитоплазмою і практично без вакуолей. Саме з таких клітин складаються апікальні меристеми і клітини зародка. У тканинах, які отримали з цих органів найлегше індукувати органогенез.
У зв’язку з цим регенерація із будь-яких клітин рослин можлива, якщо вдасться перевести ці клітини у меристемоїди, створивши відповідні умови.
Навіть у рослин з високим ступенем регенерації, наприклад у тютюну, клітин-меристемоїдів не так багато: у первинному калюсі на 1000 – 10000 клітин може бути один меристемоїд. Розподіл меристимоїдів по органах рослин нерівномірний, і різні види відрізняються за вмістом меристемоїдів у тканинах окремих органів. У зв’язку з цим першочерговим завданням є вибір частини рослини, яку можна використати як первинний експлантат. Найвищий ступінь регенерації виявлений у зародків, сім’ядолей, гіпокотилів, коренів, стебла, листка, бульб, суцвіття і пиляків.
Встановлено, що у багаторічних рослин, як і у однорічних, прояв тотипотентності клітин у тканинах і органах поточного року знижується на пізніших етапах. Це може свідчити про зниження у рослині концентрації меристемоїдів з віком або про поступове зниження їх компетентності. Так, регенерація рослин кукурудзи або кофе можлива із калюсу, який отримують із незрілих зародків, які виділені задовго до дозрівання насіння. Загальновідомо, що культури тканин, які отримали із молодих листків або стебел краще здатні до регенерації рослинок. Крім цього, розвиток рослини супроводжується зниженням здатності тканин до ембріогенезу або органогенезу. Культури тканин, які отримали із дорослих рослин, звичайно не здатні до регенерації, а тому первинні експлантати деревних необхідно відбирати на ювенільних фазах розвитку.
Кількість меристемоїдів можна збільшити їх відбором. Крім того, для подальшого розвитку меристемоїдів їх необхідно відділити від немеристемоїдних клітин, так як остані пригнічують ембріогенез у цих клітин, можливо, виділяючи інгібітори. Необхідність відбору меристемоїдів обумовлена і тим, що при тривалому культивуванні тканин зменшується здатність до регенерації.
Кількість меристемоїдів і реалізація тотипотентності у значній мірі залежать від умов, у які поміщають клітину перед або під час індукції регенерації. Серед них найважливішими є: освітлення, температура і склад середовища.
Сезонні зміни поведінки ізольованих тканин звичайно пов’язані із змінами фотоперіоду і температури. Відмічено, що вміст меристемоїдних клітин і найвищий ступінь регенерації спостерігаються в разі вирощування донорних рослин при оптимальних для даного виду фотоперіоді і температурі. Експлантати, відібрані від рослин, які росли при несприятливому фотоперіоді, утворюють мало або зовсім не утворюють регенерантів, навіть якщо фотоперіод при культивуванні буде оптимальним. У більшості лабораторій стандартом є 16–годинний фотоперіод, оптимальна інтенсивність освітлення 1000 Лк. Соматичний ембріогенез, як правило, відбувається в темряві – на світлі зародки передчасно проростають. Однак відомі випадки коли соматичний ембріогенез у калюсу Nicotiana стимулювало освітлення 10000 – 15000 Лк. Значення має і спектральний склад світла: утворення адвентивних пагонів у Nicotiana tabacum найкраще відбувається при освітленні калюсу ультрафіолетовою частиною спектра (371 нм), голубою (419 – 467 нм) або пурпурною (504 – 550 нм). У іншого виду Lactuca sativa утворення пагонів стимулювало освітлення червоним світлом (660 нм) і індукція знімалась при освітленні дальнім червоним (750 нм).
Для отримання великої кількості меристемоїдних клітин і прискорення органогенезу у різних видів рослин є температурні оптимуми. З метою індукції прискорення органогенезу застосовують обробку тканин листків або стебел субоптимальними температурами (15–18° С), що покращує регенерацію при подальшому культивуванні при 21–25° С. Для деяких рослин більш ефективною є короткочасна обробка нижчою температурою (4° С).
Важливу роль у регулюванні реалізації тотипотентності рослинною клітиною відіграють біологічно активні речовини фітогормональної дії, що входять до складу середовища, а саме, ІОК і цитокініни.
Отже, для успішної реалізації рослинною клітиною властивої їй тотипотентності необхідно враховувати такі моменти:
1) вибір первинного експлантата;
2) сезонність, вік первинного експлантата;
3) умови культивування експлантатів.
Методи мікроклонального розмноження рослин
На сьогодні розроблено ряд різних способів біотехнології мікроклонального розмноження. В їх основі лежать чотири принципових підходи:
1) активація розвитку рослинних меристем (апекс пагона, пазушні і сплячі бруньки пагона);
2) утворення адвентивних бруньок із тканин експлантата;
3) індукція соматичного ембріогенезу;
4) диференціація адвентивних бруньок в первинній і перевивній калюсній тканині.
Іноді, як окрему модель виділяють культуру пиляків.
Основним методом мікроклонального розмноження рослин є активація пазушних меристем. Цей метод вже став промисловим при виробництві посадкового матеріалу деяких культур. Ця модель є найбільш надійною стосовно плодових і ягідних рослин. Вперше ця модель була розроблена на суниці на початку 70-х років минулого століття. Цей метод базується на знятті апікального домінування, чого можна досягти двома шляхами:
1. Отриманням пагонів нормальних пропорцій з послідуючим їх поділом на „однобрунькові мікроживці”, які використовують як вторинні експлантати для повторення циклу розмноження. Теоретична можливість такого способу розмноження складає приблизно 10 000 – 1 000 000 пагонів на рік.
2. Введенням в живильне середовище речовин з цитокініновою активністю, що приводить до формування пагонів з відносно вкороченими міжвузлями, а пазушні бруньки дають початок новим пагонам. Експлантати на таких середовищах набувають вигляду пучків маленьких пагонів, кожний із яких можна рекультивувати. Теоретично, можливість цього методу може становити до 15 000 000 000 бруньок або пагонів в рік від одного експлантата. Вважають, що цей метод має мінімальний ступінь ризику стосовно отримання неоднорідного потомства і частота появи мутантних рослин не перевищує частоти появи таких при звичайному розмноженні. Метод відносно універсальний і має гарну відтворюваність у межах виду і навіть роду рослин.
Другий метод – це індукція утворення адвентивних бруньок безпосередньо тканинами експлантата. Він базується на здатності ізольованих частин рослин за сприятливих умов живильного середовища відновлювати недостаючі органи і регенерувати цілі рослини (виключення становить кореневий органогенез). Майже всі органи і тканини рослин можуть утворювати адвентивні бруньки. Цей процес, як правило, відбувається на живильних середовищах, які містять лише цитокінін або в сполученні з ауксином у співвідношенні 10:1 або 100:1. З ауксинів у цьому випадку найчастіше використовують ІОК або НОК.
Цим шляхом можна розмножувати нарциси, лілії, гладіолуси, часник, цибулю, цвітну капусту, суницю, малину, яблуню, грушу та інші.
Однак, деякі дослідники вважають, що при розмноженні таким способом не виключена можливість отримання неоднорідного потомства. Справа в тому, що у тканинах експлантатів можуть бути клітини з порушеною плоїдністю. Перш за все це стосується тканин, які складаються з клітин, що швидко відмирають, наприклад, клітини кореневого чохлика. І хоча ймовірність регенерації рослин із таких клітин відносно низька, нею не можна нехтувати, так як in vitro ці клітини можуть отримати перевагу у розвитку.
В певних випадках ефективним способом розмноження рослин in vitro може бути соматичний ембріогенез – це формування зародкоподібних структур (ембріоїдів) із соматичних клітин в умовах in vitro, які при перенесенні на відповідне живильне середовище здатні розвиватися у цілу рослину. Соматичний ембріогенез наочно демонструє тотипотентність рослинних клітин.
Основна відмінність утворення зародків in vitro від in vivo полягає в тому, що соматичні зародки розвиваються асексуально поза зародковим мішком і за своїм зовнішнім виглядом нагадують біполярні структури, у яких одночасно спостерігається розвиток апікальних меристем стебла і кореня.
Соматичний ембріогенез включає фази розвитку, аналогічні фазам зиготичного ембріогенезу: глобули, серця, торпеди, молодого проростка (рис. 3).
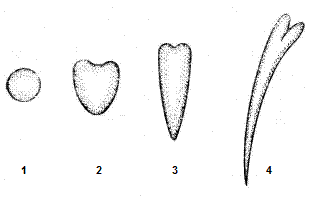
Рис.3. Стадії ембріогенезу: 1 – глобула; 2 – серце; 3 – торпеда; 4 – молодий проросток.
У деяких випадках ембріоїди утворюються безпосередньо із клітин тканини, яка культивується in vitro, - це так званий прямий ембріогенез. В інших випадках спочатку формується калюс, а вже з нього розвиваються зародки – це непрямий ембріогенез.
Ембріоїди утворюються з поодиноких клітин, розташованих в основному на поверхні калюсу. Вони відрізняються щільнішою цитоплазмою, відносно великим ядром із збільшеним ядерцем, містять дрібні вакуолі. Це метаболічно активні клітини, багаті білками і РНК. Оточуючі вакуолізовані клітини виконують функцію “тканини-няньки”.
Формування ембріоїдів у культурі тканин проходить у два етапи. На першому етапі клітини експлантата дедиференціюються за рахунок додавання в живильне середовище ауксинів, як правило, 2,4-Д і перетворюються на ембріональні. На наступному етапі з цих клітин розвиваються ембріоїди. Відбувається це при зменшенні концентрації ауксину або взагалі повного його виключення із складу живильного середовища.
Ембріогенез легше відбувається у молодих культурах. В міру подовження строку культивування ембріогенна активність клітин послаблюється. Так у моркви ембріоїди починають утворюватися через 4-6 тижнів після отримання калюсу, оптимальний вік культури для індукції соматичного ембріогенезу – 15-20 тижнів; 30-40-тижнева культура часто втрачає ембріогенний потенціал.
Четвертий метод мікроклонального розмноження - диференціація адвентивних бруньок в первинній і перевивній калюсній тканині. Цей метод мало використовується для отримання посадкового метеріалу in vitro. Це пов’язане з тим, що при тривалому культивуванні калюсу спостерігаються зміни плоїдності клітин, структурні перебудови хромосом, накопичення генних мутацій і зменшення або і втрата морфогенного потенціалу. Тому цей метод мікроклоноального розмноження доцільно використовувати лише для тих рослин, для яких притаманна генетична стабільність калюсної тканини, а варіабельність між рослинами-регенерантами не перевищує рівня природної мінливості. До таких рослин можна віднести томати, спаржу, деякі деревні породи. Через калюсну культуру були також розмножені цукровий буряк, кукурудза, рис, пшениця, соняшник, льон, картопля, огірок.
 2015-09-06
2015-09-06 1939
1939








