Метод кулонометрии основан на измерении количества электричества, затраченного на электрохимическую реакцию. Последняя приводит к количественному окислению или восстановлению определяемого вещества или же к получению промежуточного реагента, который стехиометрически реагирует с определяемым веществом.
Основой метода кулонометрического анализа являются законы Фарадея:
1. Количество электропревращенного (восстановленного или окисленного) в процессе электролиза вещества прямо пропорционально количеству прошедшего электричества;
2. Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам.
Электрохимический эквивалент — это масса вещества, выделившегося на электроде (или растворившегося с электрода) в процессе электролиза при протекании единицы количества электричества, т. е. 1 Кл.
В соответствии с законами Фарадея массу электрохимически превращенного вещества, P, можно найти по следующей формуле
|
|
|
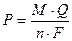 | (2.7) |
M — молекулярная масса, Q — количество электричества, F — число Фарадея, равное 96485 Кл, n — число электронов, участвующих в электрохимической реакции.
Применение формулы (..) возможно только при 100 % выходе по току, т. е. в отсутствии конкурирующих реакций.
Электролиз в кулонометрической ячейке можно проводить либо при постоянной силе тока (гальваностатическая кулонометрия), либо при постоянном потенциале (потенциостатическая кулонометрия). По методике выполнения различают прямую кулонометрию и косвенную (кулонометрическое титрование).
 2015-09-06
2015-09-06 720
720








