Вольтамперометрический метод анализа основан на использовании явления поляризации микроэлектрода, получении и интерпретации вольтамперных (поляризационных) кривых, отражающих зависимость силы тока (I) от приложенного напряжения (Е).
В вольтамперометрии используют два электрода: рабочий поляризуемый с малой поверхностью и неполяризуемый электрод сравнения. Если в качестве рабочего выбран электрод с постоянно обновляющейся поверхностью (например, ртутный капающий электрод), то метод называют полярографическим.
Если в растворе присутствуют вещества, способные электрохимически восстанавливаться или окисляться, то при наложении на ячейку линейно изменяющегося напряжения (со скоростью, не превышающей 200 мВ/мин) кривая I = f (Е) имеет форму волны (в отсутствии электрохимических реакций эта зависимость линейна, как следует из закона Ома).
При низких значениях потенциала через ячейку проходит очень незначительный остаточный ток, обусловленный прежде всего током заряжения двойного электрического слоя и присутствием в растворе электрохимически более активных, чем анализируемое вещество, примесей. При увеличении потенциала электрохимически активное вещество (называемое деполяризатором) вступает в электрохимическую реакцию на электроде и ток в результате этого резко возрастает. Это так называемый фарадеевский ток (I Ф). С ростом концентрации ток возрастает до некоторого предельного значения, оставаясь затем постоянным. Предельный ток обусловлен тем, что в данной области потенциалов практически весь деполяризатор из приэлектродного слоя исчерпан в результате электрохимической реакции, обедненный слой обогащается за счет диффузии деполяризатора из объема раствора. Скорость диффузии в этих условиях контролирует скорость электрохимического процесса в целом. Такой ток называют предельным диффузионным (I Д).
|
|
|
Для того чтобы исключить электростатическое перемещение деполяризатора и понизить сопротивление в ячейке, измерение проводят в присутствии большого избытка сильного электролита, называемого фоном. Вещество фонового раствора может вступать в химическую реакцию (часто реакцию комплексообразования) с определяемым веществом. Фоновый электролит может одновременно играть роль буферного раствора.
Вольтамперная кривая описывается уравнением Гейровского-Ильковича
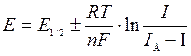 | (2.1) |
где E — потенциал в любой точке полярографической волны; E 1/2 — потенциал на половине ее высоты; n — число электронов, участвующих в электрохимической реакции; I д — предельно диффузионный ток; I — ток для выбранного значения E.
Вольтамперная кривая содержит ценную аналитическую информацию: потенциал полуволны Е 1/2 является качественной характеристикой деполяризатора, в то время как предельный диффузионный ток I д линейно связан с концентрацией его в объеме раствора (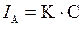 ).
).
|
|
|
Потенциал полуволны может быть определен графически (рис. 2.2). На участке резкого возрастания тока для разных значений потенциала определяют ток, измеряют значение предельно диффузионного тока и вычисляют 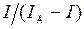 .Строят график зависимости
.Строят график зависимости 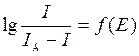 . При
. При 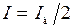
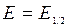 ;
; 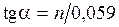 .
.
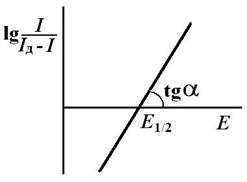
Рис. 2.2.Графическое определение потенциала полуволны
С использованием табличных данных по Е 1/2 идентифицируют деполяризатор. При затруднении расшифровки полярограмм применяют метод «свидетеля»: после регистрации полярограммы анализируемого раствора к этому раствору в электролизер поочередно добавляют стандартные растворы предполагаемых соединений. Если предположение было верным, увеличивается высота полярографической волны, при неверном предположении появляется дополнительная волна при другом потенциале.
На рис.2.3 представлен пример полярографической кривой (состоящей из двух волн), которая соответствует присутствию в растворе электролита двух восстанавливающихся веществ с разными потенциалами полуволны.
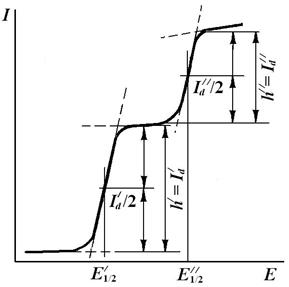
Рис. 2.3. Полярограмма, соответствующая содержанию в растворе
электролита двух восстанавливающихся веществ с потенциалами
полуволны Е /1/2 и Е //1/2
Помимо классического полярографического метода широко используют десятки других разновидностей вольтамперометрии, например, с линейной разверткой потенциала, переменнотоковую, инверсионную и др.
В вольтамперометрии с линейной разверткой потенциала микроэлектрод поляризуется напряжением, изменяющимся с большой скоростью (до 100 В/с) по определенному закону. Скорость диффузии деполяризатора в приэлектродный слой становится меньше скорости электрохимического процесса, вследствие этого приэлектродный слой истощается, ток уменьшается., и вольтамперная кривая приобретает вид пика. Потенциал, соответствующий пику, является качественной характеристикой, высота пика — количественной, причем она зависит от скорости изменения поляризующего напряжения.
В переменнотоковой вольтамперометрии наряду с постоянным напряжением на электроды накладывается переменное напряжение небольшой амплитуды (до 50 мВ). С помощью синхронного усилителя выделяют переменную компоненту измеряемого модулированного тока и строят ее зависимость от среднего приложенного потенциала. Количественная характеристика полярограммы зависит от параметров процесса.
Инверсионно – вольтамперометрический (ИВ) метод основан на способности определяемого элемента электрохимически накапливаться на поверхности рабочего электрода и растворяться в процессе анодной или катодной поляризации при определенном потенциале, характерном для каждого элемента. Регистрируемый на вольтамперограмме максимальный ток (пик) элемента прямо пропорционален массовой концентрации определяемого элемента в растворе. Аналитическим сигналом в методе ИВ является ток растворения концентрата, осажденного на электроде и имеющий форму колоколообразного импульса (пика). В концентрируемых условиях высота пика прямо пропорциональна концентрации определяемого вещества или иона, а потенциал анодного пика характеризует природу химического вещества в анализируемых условиях.
Метод ИВ состоит из двух стадий: 1) концентрирование вещества (элемента) на поверхности электрода при перемешивании раствора и постоянном потенциале; 2) электрохимическое растворение концентрата и фиксирование изменения какой-либо электрохимической характеристики электрода: тока, потенциала или количества протекшего электричества.
На рис. 2.4 в качестве примера приведены вольтамперограммы, полученные методом инверсионной вольтамперометрии.
|
|
|
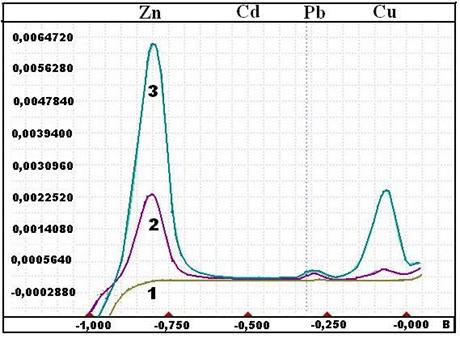
Рис. 2.4. Вольтамперограммы фонового электролита (1), пробы (2) и пробы с добавками аттестованной смеси элементов (3) при
одновременном определении цинка, кадмия, свинца и меди в волосах человека
Интервал определения концентрации в вольтамперометрии рамен 10-2 – 10-6 М,(в переменнотоковой — 10-8 М, в инверсионной — 10-9 М). При определении малых концентраций погрешность не превышает 3 %.
2.2. Кондуктометрия
Метод кондуктометрии основан на изучении зависимости между проводимостью раствора и концентрацией ионов в этом растворе.
Электрическая проводимость (электропроводность) раствора электролита является результатом диссоциации растворенного вещества и миграции ионов под действием внешнего источника напряжения. Электропроводность раствора определяется, в основном, числом, скоростью (подвижностью) мигрирующих ионов, количеством переносимых ими зарядов и зависит от температуры и природы растворителя, вязкости и диэлектрической проницаемости.
Различают удельную (æ) и эквивалентную (l) электропроводность. По определению удельная электропроводность — это электропроводность 1 см3 раствора, находящегося между плоскопараллельными электродами, расстояние между которыми равно 1 см, причем этот кубический сантиметр выбран вдали от краев пластин электродов. Или упрощенно: удельной электропроводностью называется электропроводность 1 см3 раствора, заключенного между двумя параллельными электродами площадью 1 см2 и расположенными на расстоянии 1 см друг от друга. Размерность удельной электропроводности — См×м-1 (Ом-1×м-1), однако часто пользуются размерностью См×см-1.
Удельная электропроводность равна:
æ 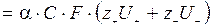 , , | (2.2) |
где a — степень диссоциации электролита; С — концентрация электролита; F — число Фарадея; U+, U- — электрофоретическая подвижность ионов (скорость движения ионов в единичном поле), z+, z- — зарядные числа ионов.
Эквивалентная электропроводность — это электропроводность раствора, содержащего 1 грамм-эквивалент электролита, измеренная при расстоянии между электродами 1 см.
|
|
|
На рис. 2.5 представлены кривые зависимости удельной электропроводности от концентрации слабых и сильных электролитов.
Как видно из рис. 2.5, с ростом концентрации электролита удельная электропроводность сначала растет, затем падает. Рост электропроводности связан с увеличением количества ионов – переносчиков заряда. Дальнейшее уменьшение удельной электропроводности для сильных электролитов связано с электрофоретическим и релаксационным эффектами, а для слабых электролитов — с уменьшением степени диссоциации.
Метод кондуктометрии может быть реализован в варианте прямой кондуктометрии или кондуктометрического титрования. Прямую кондуктометрию применяют для определения концентрации раствора сравнительно редко, поскольку регистрируемый сигнал не избирателен (электропроводность раствора — величина аддитивная). Прямую кондуктометрию обычно используют для оценки чистоты растворителя, определения общего солевого состава природных и сточных вод.
В кондуктометрическом титровании правильным подбором титранта и растворителя создают благоприятные условия, при которых получается кривая титрования с резким изломом. На рис. 2.6 приведен пример кондуктометрического титрования смеси сильной и слабой кислот сильной щелочью.
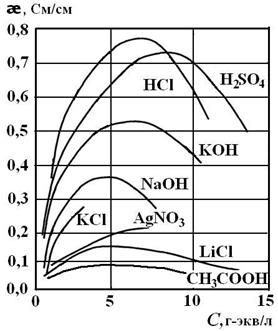 Рис. 2.5. Зависимость удельной электропроводности электролитов от их концентрации Рис. 2.5. Зависимость удельной электропроводности электролитов от их концентрации | 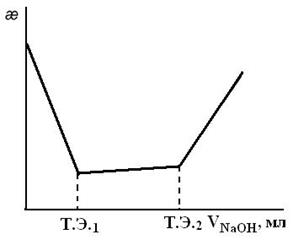 Рис. 2.6. Кривая кондуктометрического титрования смеси сильной и слабой кислот сильной щелочью Рис. 2.6. Кривая кондуктометрического титрования смеси сильной и слабой кислот сильной щелочью |
Из рис. 2.6 видно, что в первую очередь в реакцию со щелочью вступает сильная кислота и только после того, как она будет полностью нейтрализована, начнет реагировать со щелочью слабая кислота. В этом случае наблюдаются две эквивалентные точки.
Погрешность определения конечной точки титрования невелика (2%). Нижний предел определяемых в методе концентраций составляет 10-4 моль/л.
Простейшая ячейка для кондуктометрии представляет собой два электрода, погруженные в раствор электролита (рис. 2.7), причем, согласно определению, площадь металлических каждой металлической пластинки равна 1 см2, расстояние между ними — 1 см.. В то же время, форма и конструкция электродов могут быть самыми разнообразными. Так, например, в портативном кондуктометре фирмы HANNA (рис. 2.8) ячейка представляет собой стержень с металлическим концом и несколькими металлическими кольцами, помещаемый в пластиковый «футляр» без дна, имеющий круглое отверстие в верхней части. При измерении электропроводности электрод помещается в анализируемый раствор; удаление пузырьков из системы происходит путем постукивания электрода о стенку емкости с раствором электролита.
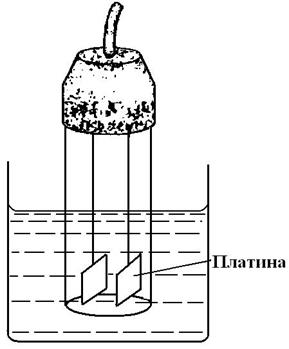 Рис. 2.7. Классическая кондуктометрическая ячейка Рис. 2.7. Классическая кондуктометрическая ячейка |  Рис. 2.8..HI 8733 портативный кондуктометрфирмы HANNA Рис. 2.8..HI 8733 портативный кондуктометрфирмы HANNA |
Современные кондуктометрические датчики проводят автоматическую термокомпенсацию и выдают значения удельной электропроводности, приведенные к 25°С.
 2015-09-06
2015-09-06 16505
16505








