Потенциометрический метод, основанный на измерении электродвижущих сил (ЭДС) обратимых гальванических элементов, используют для определения содержания веществ в растворе и измерения различных физико-химических величин. В потенциометрии обычно применяют гальванический элемент, включающий два электрода, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом).
Индикаторным является электрод, потенциал которого зависит от активности (концентрации) определенных ионов в растворе. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов (электрод сравнения).
В основе потенциометрического анализа лежит зависимость равновесного электродного потенциала E от активности компонентов электрохимической реакции
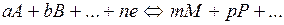 , ,
| (2.3) |
где A, B, M, P, … — участники реакции; a, b, m, p, … — стехиометрические коэффициенты при компонентах (участниках) реакции
Эта зависимость описывается уравнением Нернста:
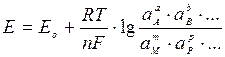 , ,
| (2.4) |
где E 0 — стандартный потенциал редокс-системы; R — универсальная газовая постоянная, равная 8,312 Дж/(моль К); T — абсолютная температура, К; F — постоянная Фарадея, равная 96485 Кл/моль; n — число электронов, принимающих участие в электродной реакции; 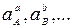 — активности исходных компонентов;
— активности исходных компонентов; 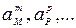 — активности продуктов реакции; активности твердых и газообразных компонентов и растворителей принимают за единицу.
— активности продуктов реакции; активности твердых и газообразных компонентов и растворителей принимают за единицу.
Потенциометрический анализ широко применяют для непосредственного определения активности ионов, находящихся в растворе (прямая потенциометрия — ионометрия), а также для индикации точки эквивалентности при титровании по изменению потенциала индикаторного электрода в ходе титрования (потенциометрическое титрование). При потенциометрическом титровании могут быть использованы следующие типы химических реакций, в ходе которых изменяется концентрация потенциалопределяющих ионов; реакция кислотно-основного взаимодействия, реакция окисления-восстановления, реакция осаждения и комплексообразования.
В потенциометрии используют два основных класса индикаторных электродов.
1. Электроды, на межфазных границах которых протекают реакции с участием электронов. Такие электроды называют электронообменными или окислительно-восстановительными.
2. Электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными или ионообменными, а также ионселективными.
В качестве электронообменных применяют электроды из химически инертных металлов — платины, золота и др.
 2015-09-06
2015-09-06 676
676








