(для студентов инженерно – технологического факультета)
| Периодическая система элементов | |||||||||||||||||||||||
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
Гродно 2009
УДК: 546 (076.5)
ББК 24.1 Я 73
Р 13
Авторы: Апанович З.В., Лукашенко Ю.А.
Рецензенты:: профессор, доктор биологических наук З.В. Горбач, доцент, кандидат химических наук Л.И. Хмылко
|
Учебно-методическое пособие включает лекции по отдельным темам курса «
Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
|
Рекомендовано межфакультетской методической комиссией инженерно – технологического факультета 2009 г. (протокол №).
© УО «Гродненский государственный аграрный университет», 2009
Апанович З.В.,2009
| Тема № | СОДЕРЖАНИЕ | Стр. |
| Химические свойства s– элементов 1 группы ПС и их соединений | ||
| Химические свойства s– элементов 11 группы ПС и их соединений | ||
| Р-элементы (общие сведения) | ||
| Химические свойства р – элементов 111 группы ПС и их соединений | ||
| Химические свойства р – элементов 1V группы ПС и их соединений | ||
| Химические свойства р – элементов V группы ПС и их соединений | ||
| Химические свойства р – элементов V1 группы ПС и их соединений | ||
| Химические свойства р – элементов V11 группы ПС и их соединений | ||
| d – элементы (общие сведения) | ||
| Химические свойства d – элементов 1 группы ПС и их соединений | ||
| Химические свойства d– элементов 11 группы ПС и их соединений | ||
| Химические свойства d– элементов 1V группы ПС и их соединений | ||
| Химические свойства d– элементов V11 группы ПС и их соединений | ||
| Химические свойства d– элементов V111 группы ПС и их соединений | ||
| Таблица распределения номеров индивидуальных заданий, соответствующих каждому варианту. |
ТЕМА 1: ХИМИЧЕСКИЕ СВОЙСТВА S – ЭЛЕМЕНТОВ 1 ГРУППЫ ПС И ИХ СОЕДИНЕНИЙ.
Комментарии для работы с рабочими тетрадями.
1. Li2CO3 + HCI  Обмен. Более сильная кислота вытесняет более слабую из её соли. Газообразный продукт удаляется из реакционной системы. Обмен. Более сильная кислота вытесняет более слабую из её соли. Газообразный продукт удаляется из реакционной системы. |
2.LiCI 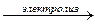 Электролиз расплава до простых веществ. Электролиз расплава до простых веществ. |
3. LiH + O2  Реакция горения до оксидов, которые реагируют между собой. Реакция горения до оксидов, которые реагируют между собой. |
4. Na + O2  Образуется пероксид натрия. Образуется пероксид натрия. |
5. Na + NH3  Замещение натрием водорода до амида. Реакция может идти в три стадии при избытке натрия. Замещение натрием водорода до амида. Реакция может идти в три стадии при избытке натрия. |
6. Na2O + O2  Образуется пероксид. ОВР, соединения. Образуется пероксид. ОВР, соединения. |
7. Na2O2 + Na  Образуется оксид. ОВР. Образуется оксид. ОВР. |
8. Na2O2 + O2 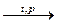 Образуется супероксид. ОВР соединение. Образуется супероксид. ОВР соединение. |
9. Na2O2 + CO2  ОВР О-1 диспропорционирует. Эта реакция используется в подводных лодках и в костюмах с замкнутыми циклами дыхания. ОВР О-1 диспропорционирует. Эта реакция используется в подводных лодках и в костюмах с замкнутыми циклами дыхания. |
10. Na2O2 + H2O  Реакция гидролиза (обмена), с образованием перексида водорода. Реакция гидролиза (обмена), с образованием перексида водорода. |
11. NaCI + H2O 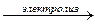 Образуется щелочь и 2 простых вещества. Образуется щелочь и 2 простых вещества. |
12. Na2O2 + KJ + H2SO4  ОВР, О-1 окислитель, восстановитель J-1. ОВР, О-1 окислитель, восстановитель J-1. |
13. Na2O2 + KMnO4 + H2SO4  ОВР, О-1 восстановитель, Mn+7 окислитель. ОВР, О-1 восстановитель, Mn+7 окислитель. |
14. Na2O2 + Fe(OH)2 + H2O  ОВР, О-1 окислитель, восстановитель Fe +2. ОВР, О-1 окислитель, восстановитель Fe +2. |
15. Na2CO3 + Ca(OH)2  Обмен. Выпадает осадок. Старый способ получения едкого натра. Обмен. Выпадает осадок. Старый способ получения едкого натра. |
16. NaOH + CI2  ОВР, CI2 диспропорционирует в горячей и в холодной щелочи по разному. ОВР, CI2 диспропорционирует в горячей и в холодной щелочи по разному. |
17. NaOH + S  ОВР S0 диспропорционирует на S-2, S+4. ОВР S0 диспропорционирует на S-2, S+4. |
18. NaOH + Be(OH)2  Комплексообразования у Be2+ координационное число 4. Комплексообразования у Be2+ координационное число 4. |
19. NaOH + ZnSO4  Обмен. Более сильное основание вытесняет более слабое из её соли, при избытке щелочи образуется комплекс, у Zn2+ координационное число - 4. Обмен. Более сильное основание вытесняет более слабое из её соли, при избытке щелочи образуется комплекс, у Zn2+ координационное число - 4. |
20. NaF + AIF3  Комплексообразования, у AI3+ координационное число 6 и 4. Образуется криолит, который используется в промышленности для получения фтора и как добавка при получении алюминия из расплава его оксида. Комплексообразования, у AI3+ координационное число 6 и 4. Образуется криолит, который используется в промышленности для получения фтора и как добавка при получении алюминия из расплава его оксида. |
21. NaOH + AI + H2O  ОВР AI0 - восстановитель H+ - окислитель. Комплексообразования, у AI3+ координационное число 6 и 4. Эта реакция использовалась для наполнения водородом русских аэростатов в русско-японской войне. ОВР AI0 - восстановитель H+ - окислитель. Комплексообразования, у AI3+ координационное число 6 и 4. Эта реакция использовалась для наполнения водородом русских аэростатов в русско-японской войне. |
22. NaNO3  ОВР, О-2 восстановитель, N +5окислитель. ОВР, О-2 восстановитель, N +5окислитель. |
23. Na2CO3 + SiO2  Обмен. Газообразный продукт - более летучий оксид удаляется из реакционной среды. Обмен. Газообразный продукт - более летучий оксид удаляется из реакционной среды. |
24. K + O2  Образуется надпероксид. Образуется надпероксид. |
25. K + O3  Образуется озонид. Образуется озонид. |
26. KO2 + K  Образуется пероксид или оксид. Соединения. Образуется пероксид или оксид. Соединения. |
27. KO2 + H2O  ОВР О-1/2 диспропорционирует. ОВР О-1/2 диспропорционирует. |
28. KHCO3  реакция разложения (не ОВР) реакция разложения (не ОВР) |
29. KOH + Zn + H2O  ОВР, Zn 0 - восстановитель H+ - окислитель. Комплексообразование у Zn 2+ координационное число 4. ОВР, Zn 0 - восстановитель H+ - окислитель. Комплексообразование у Zn 2+ координационное число 4. |
30. KOH + Si + H2O  ОВР. Si 0 - восстановитель H+ - окислитель. Образуется соль кремниевой кислоты. ОВР. Si 0 - восстановитель H+ - окислитель. Образуется соль кремниевой кислоты. |
31. KH + H2O  Реакция обмена и ОВР одновременно. Образующийся молекулярный водород состоит из Н- и Н+. Реакция обмена и ОВР одновременно. Образующийся молекулярный водород состоит из Н- и Н+. |
32. KH + AIH3  Комплексообразования, у AI3+ координационное число 4. Комплексообразования, у AI3+ координационное число 4. |
33. K2O + H3РO4  реакция обмена (нейтрализации) реакция обмена (нейтрализации) |
34. KO2 + H2SO4  ОВР. О-1/2 диспропорционирует. ОВР. О-1/2 диспропорционирует. |
35. KO3  ОВР. О-1/3 диспропорционирует. ОВР. О-1/3 диспропорционирует. |
36. K3PO4 + H2O  гидролиз по аниону. гидролиз по аниону. |
37. KO3 + H2O  ОВР. О-1/3 диспропорционирует. ОВР. О-1/3 диспропорционирует. |
38. Na + NH3  Замещение натрием водорода до амида. реакция может идти в три с стадии при избытке натрия. Замещение натрием водорода до амида. реакция может идти в три с стадии при избытке натрия. |
39. NaNH2 + H2O  гидролиз (обмен). Газообразный продукт удаляется из реакционной среды. гидролиз (обмен). Газообразный продукт удаляется из реакционной среды. |
40. KO2 + CO2  ОВР. О-1/2 диспропорционирует. ОВР. О-1/2 диспропорционирует. |
41. Na2CO3 + CrCI3 + H2O  совместный гидролиз с образованием соли сильной кислоты и сильного основания, слабый анион и катион гидролизуются полностью и необратимо, их продукты уходят из зоны реакции. совместный гидролиз с образованием соли сильной кислоты и сильного основания, слабый анион и катион гидролизуются полностью и необратимо, их продукты уходят из зоны реакции. |
42.Na2O2 + H2SO4  обмен (не ОВР) обмен (не ОВР) |
1 вариант:
Какое свойство s-элементов характеризует их как активных восстановителей? Как изменяется восстановительная активность элементов IA групп по мере увеличения порядкового номера? Почему?
Осуществите цепочку превращений:
H2 ® NaH ® H2 ® HBr ® HCl ® H2 ® H2O2 ® H2 ® CH4 ® C2H2 ® H2O.
Na2O2 + KJ + H2SO4  ОВР
ОВР
О-1 окислитель, восстановитель J-1.
2 вариант:
Как можно получить гидроксиды щелочных металлов? Почему едкие щелочи необходимо хранить в хорошо закрытой посуде? Составьте уравнения реакций, при насыщении едкого натра: а) хлором; б) сернистым ангидридом; в) сероводородом.
Осуществите цепочку превращений:
Na2O2 ® NaOH ® NaCl ® Na ® Na3P ® NaOH ® Na2CO3 ® NaI ® NaCl ® NaNO3 ® NaNO2
Na2O2 + KMnO4 + H2SO4  ОВР
ОВР
О-1 восстановитель, Mn+7 окислитель.
3 вариант:
Напишите уравнения реакций получения из карбоната натрия: а) силиката натрия; б) ацетата натрия; в) нитрата натрия; г) гидросульфата натрия; д) сульфита натрия.
Осуществите цепочку превращений:
Na2SiO3 ® Na2SO4 ® NaCl ® NaNO3® NaNO2® NaI ® NaCl ® NaOH ®NaClO3® NaCl® NaOH
Na2O2 + Fe(OH)2 + H2O  ОВР О-1 окислитель, восстановитель Fe +2.
ОВР О-1 окислитель, восстановитель Fe +2.
4 вариант:
Опишите методы получения щелочных металлов.
Осуществите цепочку превращений:
K2СO3 ® KCl ® KNO3® KNO2 ® KI ® I2 ® NaI ® NaCl ® Cl2 ®NaClO® NaI® NaCl ® NaOH
NaOH + CI2  ОВР
ОВР
CI2 диспропорционирует в горячей и в холодной щелочи по разному.
5 вариант:
В виде каких ионов может входить водород в состав химических соединений?
Осуществите цепочку превращений:
KClO3 ® KCl ® KOH ® KClO ® O2 ® KO2 ® Na2O2® NaClO ® Cl2 ® KClO3 ® KCl
NaOH + S  ОВР S диспропорционирует
ОВР S диспропорционирует
6 вариант:
Как получают водород в промышленности и в лаборатории? Привести уравнения реакций.
Осуществите цепочку превращений:
Na2SiO3 ® Na2SO4 ® NaCl ® NaNO3® NaI ®NaCl ® Cl2 ®NaClO® NaI® NaCl ® NaOH
NaOH + AI + H2O  ОВР AI0восстановитель H+ окислитель. Комплексообразование у AI3+ координационное число 6 и 4.
ОВР AI0восстановитель H+ окислитель. Комплексообразование у AI3+ координационное число 6 и 4.
7 вариант:
Назовите три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается и каковы ее свойства?
Осуществите цепочку превращений:
NaOH ® NaCl ® NaF ® NaBr® NaNO3 ® NaNO2® NaI ® NaCl ® NaOH ® NaHCO3® NaI.
KOH + Zn + H2O  ОВР
ОВР
Zn 0восстановитель H+ окислитель. Комплексообразование, у Zn 2+ координационное число 4
.
8 вариант:
Какие степени окисления у кислорода в соединениях со щелочными металлами. приведите примеры данных соединений и назовите их.
Осуществите цепочку превращений:
Н2 ® НВr ® H2 ® HCl ® H2O2 ® KOH ® KCLO3 ® O2 ® Li2O ® Li (NO3)3 ® O2.
KOH + Si + H2O  ОВР
ОВР
Si 0восстановитель H+ окислитель.
9 вариант:
В чем отличительная особенность лития. Как изменяетсяч окраска пламени в зависимости от присутствия ионов щелочных металлов. В чем заключается сущность наблюдаемого явления изменение окраски пламени. Где применяется данное явление?
Осуществите цепочку превращений:
Na2SO4 ® NaBr ® Br2 ® HBr ® NaBr ®Na2S ® Na2SO4 ® NaCl® Na ® Na2SO3 ® NaCl
Na2O2 + CO2  ОВР
ОВР
О-1 диспропорционирует.
10 вариант:
Что такое питьевая, кальцинированная, каустическая сода, какие природные материалы содержат s - элементы первой группы. напишите их формулы дайте им названия. биогенные функции элементов второй группы.
Осуществите цепочку превращений:
H2 ® NaH ® H2 ® HBr ® HCl ® H2 ® H2O2 ® H2 ® CH4 ® C2H2 ® H2O.
Na2O2 + KMnO4 + H2SO4  ОВР
ОВР
О-1 восстановитель Mn+7 окислитель.
 2015-10-16
2015-10-16 915
915







