Комментарии для работы с рабочими тетрадями.
1. BeCI2 + LiH  Комплексообразование у Be2+ координационное число 4 с образованием соли сильной кислоты и сильного основания. Комплексообразование у Be2+ координационное число 4 с образованием соли сильной кислоты и сильного основания. |
2. BaSO4 + C  ОВР C 0 восстановитель S+6 окислитель до S-2. ОВР C 0 восстановитель S+6 окислитель до S-2. |
3. Mg + CO2  ОВР. Магний горит в атмосфере углекислого газа. ОВР. Магний горит в атмосфере углекислого газа. |
4. BaH2 + H2O  Реакция обмена с образованием молекулы водорода, состоящей из гидрид аниона и гидрид катиона. Реакция обмена с образованием молекулы водорода, состоящей из гидрид аниона и гидрид катиона. |
5. Ba + H2SO4 к  ОВР Ba 0 восстановитель S+6 окислитель. чем более активный метал, те более полно восстанавливается сера до S-2. ОВР Ba 0 восстановитель S+6 окислитель. чем более активный метал, те более полно восстанавливается сера до S-2. |
6. MgO + P2O5  соединение (не ОВР) соединение (не ОВР) |
7. CaO + C  ОВР, образуется карбид кальция со степенью окисления С-1, углерод диспропорционирует. ОВР, образуется карбид кальция со степенью окисления С-1, углерод диспропорционирует. |
8. BeCI2 + H2O  гидролиз по катиону. гидролиз по катиону. |
9. Ca(OH)2 + CI2  ОВР CI20 диспропорционирует с образованием хлорной извести. ОВР CI20 диспропорционирует с образованием хлорной извести. |
10. Be(OH)2 + NaOH  Комплексообразование у Be2+ координационное число 4. Комплексообразование у Be2+ координационное число 4. |
11. BeF2 + NaF  Комплексообразование у Be2+ координационное число 4 Комплексообразование у Be2+ координационное число 4 |
12. CaH2 + O2  Реакция горения до оксидов, которые реагируют между собой. Реакция горения до оксидов, которые реагируют между собой. |
13. BaH2 + H2O  Реакция обмена и ОВР одновременно с образованием молекулярного водорода состоящего из Н- и Н+. Реакция обмена и ОВР одновременно с образованием молекулярного водорода состоящего из Н- и Н+. |
14. SrO + SiO2  соединение (не ОВР) соединение (не ОВР) |
15. BeO + NaOH + H2O  Комплексообразование у Be2+ координационное число 4.(не ОВР). Комплексообразование у Be2+ координационное число 4.(не ОВР). |
16. CaCO3 + CO2 + H2O  соединение (не ОВР) соединение (не ОВР) |
17. BaO2 + H2SO4  реакция обмена с образованием перекиси. (не ОВР). реакция обмена с образованием перекиси. (не ОВР). |
18. Ba(OH)2 + NO2  ОВР N+4 диспропорционирует с образованием нитрата и нитрита одновременно. ОВР N+4 диспропорционирует с образованием нитрата и нитрита одновременно. |
19. CaC2 + HCI  реакция обмена с образованием ацетилена. Газообразный продукт удаляется из реакционной среды. реакция обмена с образованием ацетилена. Газообразный продукт удаляется из реакционной среды. |
20. CaCO3 + Na2CO3 + SiO2  образование стекла. Соединение не ОВР. образование стекла. Соединение не ОВР. |
21. Ba(NO3)2  ОВР восстановитель О-2, окислитель N+5. ОВР восстановитель О-2, окислитель N+5. |
22. Ca3(PO4)2 + H2SO4  реакция обмена с образованием осадка. реакция обмена с образованием осадка. |
23. BeO + HFизбыток  реакция с образованием комплексной кислоты, у Be2+ координационное число 4. реакция с образованием комплексной кислоты, у Be2+ координационное число 4. |
24. MgCI2  Электролиз расплава до простых веществ. Электролиз расплава до простых веществ. |
25. Ca + H2O  ОВР. Ca0 восстановитель, Н+ окислитель. ОВР. Ca0 восстановитель, Н+ окислитель. |
26. Be(OH)2 + HCI  реакция обмена с образованием воды. реакция обмена с образованием воды. |
27. Ba(OH)2 + NH4CI  Обмен. Газообразный продукт удаляется из реакционной среды. Обмен. Газообразный продукт удаляется из реакционной среды. |
28. CaC2 + H2O  Обмен. Газообразный продукт удаляется из реакционной среды. Обмен. Газообразный продукт удаляется из реакционной среды. |
29. CaS + H2O  Гидролиз по аниону. Гидролиз по аниону. |
30. BaO2 + KMnO4 + H2SO4  ОВР О-1 восстановитель, Mn+7 окислитель. ОВР О-1 восстановитель, Mn+7 окислитель. |
31. CaCI2 + H2C2O4  Реакция обмена с образованием осадка. Реакция идет так как у оксалата кальция низкое значение ПР. Реакция обмена с образованием осадка. Реакция идет так как у оксалата кальция низкое значение ПР. |
32. Ca3(PO4)2 + H3PO4  Реакция соединения (при избытке кислоты образуются устойчивые в растворе дигидрофосфаты). Реакция соединения (при избытке кислоты образуются устойчивые в растворе дигидрофосфаты). |
33. BeH2 + NaH  Комплексообразование у Be2+ координационное число 4. Комплексообразование у Be2+ координационное число 4. |
34. BeCI2  Электролиз расплава до простых веществ. Электролиз расплава до простых веществ. |
35. CaO + H2O  Реакция соединения (не ОВР). Гашение негашеной извести. Реакция соединения (не ОВР). Гашение негашеной извести. |
36. Ca(OH)2 + CI2O  Реакция обмена с образованием соли с такой же степенью окисления хлора как и в оксиде. (Не ОВР). Реакция обмена с образованием соли с такой же степенью окисления хлора как и в оксиде. (Не ОВР). |
37. Be2C + H2O  реакция обмена между катионами Be2+, H+ и анионами С-4, OH- . реакция обмена между катионами Be2+, H+ и анионами С-4, OH- . |
38. SrCO3 + HCI  Обмен. Более сильная кислота вытесняет более слабую из её соли. Газообразный продукт удаляется из реакционной среды. Обмен. Более сильная кислота вытесняет более слабую из её соли. Газообразный продукт удаляется из реакционной среды. |
39. CaCI2 + H2SO4  Реакция обмена с образованием осадка. Реакция обмена с образованием осадка. |
40. BaO2 + FeSO4 + H2SO4  ОВР О-1 окислитель, восстановитель Fe +2. ОВР О-1 окислитель, восстановитель Fe +2. |
Растворимые соли Са и Мg обусловливают жесткость воды. Различают временную и постоянную жесткость воды. Временная (карбонатная) жесткость воды связана с наличием в воде растворимых гидрокарбонатов Са и Мg. Ее устраняют нагреванием:
Са(НСО3)2 = СаСО3¯ +СО2 + Н2О
или добавлением известковой воды:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3¯ + 2Н2О.
Постоянная жесткость обусловлена наличием в растворе Са- и Мg-солей сильных кислот – сульфатов, хлоридов. Кипячением она не устраняется. Постоянная жесткость удаляется добавлением соды: МgSO4 + Na2CO3 = МgСО3¯ + Na2SO4.
Степень жесткости воды выражается числом миллиэквивалентов (мэкв) ионов Са2+ и Мg2+, содержащихся в 1 л воды:
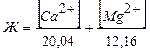 , (мэкв/л)
, (мэкв/л)
где [Ca2+] и [Mg2+] – концентрация ионов Ca2+ и Mg2+ (мг/л).
1 вариант:
Какое свойство s-элементов IIА группы характеризует их как активные восстановители? Как изменяется восстановительная активность элементов и IIА группы по мере увеличения порядкового номера? Почему?
Сколько граммов MgSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 м-экв/л?
Составьте уравнения реакций для осуществления следующих превращений: Ca®CaO®Ca(OH)2®CaOCl2®CaSO4®CaCO3® Ca(HCO3)2 ® CaCO3® CaO® CaC2 ® Ca(NO3)2.
BaSO4 + C  ОВР C 0 восстановитель S+6 окислитель до S-2.
ОВР C 0 восстановитель S+6 окислитель до S-2.
2 вариант:
Какие соединения называются гашеной и негашеной и хлорной известью? Составьте уравнения реакций их получения. Какое соединение образуется при накаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната кальция и 61,2 г сульфата магния.
Составьте уравнения реакций для осуществления следующих превращений:
Ca ® CaO ® Ca(OH)2 ® Ca(HCO3)2 ® CaCO3 ® CaO ® CaC2 ® Ca(OH)2 ® CaS ®CaO ® Ca.
Ba + H2SO4 к  ОВР
ОВР
Ba 0 восстановитель S+6 окислитель. Чем более активный металл, тем более полно восстанавливается сера: S-2.
3 вариант:
Гидроксид какого s-элемента обладает амфотерными свойствами? Составьте молекулярные и ионные уравнения реакций этого гидроксида: а) со щелочью; б) с кислотой.
В 220 л воды содержится 31 г сульфата магния. Чему равна жесткость этой воды?
Составьте уравнения реакций для осуществленияследующих превращений:
Mg ® MgO ® Mg(NO3)2 ® MgO ® MgCl2 ® Mg(NO3)2 ® Mg(OH)2 ® MgO® Mg ® Mg3P2 ® Mg (OH)2.
CaO + C  ОВР
ОВР
4 вариант:
Какие соединения магния и кальция применяются в качестве вяжущих строительных материалов? Чем обусловлены их вяжущие свойства?
Какую массу фосфата натрия надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 м-экв?
Составьте уравнения реакций для осуществления следующих превращений:
Са ® СаС2 ® Са(OH)2 ® СаBr2 ® CaCl2 ® Ca(NO3)2 ® O2 ®BaO2 ® BaSO4 ® BaS ® Bа(OH)2
Ca(OH)2 + CI2  ОВР
ОВР
CI20 диспропорционирует с образованием хлорки (хлорной извести).
5 вариант:
Составьте электронные и молекулярные уравнения реакций: а) кальция с водой; б) магния с азотной кислотой, учитывая максимальное восстановление последней.
В 3 м3 воды содержится 340 г сульфата магния. Вычислите жесткость этой воды.
Составьте уравнения реакций для осуществления следующих превращений:
MgCl2 ® Mg(OH)2 ® MgSO4 ® Mg(NO3)2® MgO ® MgCl2 Be(NO3)2 ® Be(OH)2 ® BeO ® BeCl2 ® K2[Be(OH)4].
Ba(OH)2 + NO2  ОВР
ОВР
N+4 диспропорционирует с образованием нитрата и нитрита одновременно.
6 вариант:
Как получают и где применяются в промышленности щелочноземельные металлы?
Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 м-экв. Какая масса гидрокарбоната магния содержится в 200 л этой воды?
Составьте уравнения реакций для осуществленияследующих превращений:
Mg ® MgO ® MgCl2 ® Mg(OH)2 ® MgSO4
Mg(NO3)2® MgO ® MgCl2
Be(NO3)2 ® Be(OH)2 ® BeO® K2[Be(OH)4].
BaO2 + KMnO4 + H2SO4  ОВР
ОВР
О-1 восстановитель, Mn+7 окислитель.
7 вариант:
Какие степени окисления у кислорода в соединениях со щелочноземельными металлами. приведите примеры данных соединений и назовите их. Опишите их свойства примерами реакций.
Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 3 л которой содержится 36,47 мг Mg2+ и 50,3 мг Са2+?
Составьте уравнения реакций для осуществленияследующих превращений:
Mg ® MgBr2 ® MgCl2 ® Mg(NO3)2 ® Mg(OH)2 ® MgO ® MgCl2
Be(NO3)2 ® Be(OH)2 ® BeO ® BeCl2 ® K2[Be(OH)4].
BaO2 + FeSO4 + H2SO4  ОВР О-1 окислитель, восстановитель Fe +2.
ОВР О-1 окислитель, восстановитель Fe +2.
8 вариант:
В чем отличительная особенность бериллия. Составьте молекулярные и ионные уравнения реакций оксида и гидроксида этого элемента, с растворами: а) щелочи; б) кислоты.
Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,1 г карбоната натрия?
Составьте уравнения реакций для осуществления следующих превращений:
СаО ® Са(ОН)2 ® СаBr2 ® CaCl2® CaCO3 ® Ca(HCO3)2 ® CaCO3 ®CaO® CaC2®Ca(OH)2®CaOCl2.
Ca(OH)2 + CI2  ОВР CI20 диспропорционирует с образованием хлорки (хлорной извести).
ОВР CI20 диспропорционирует с образованием хлорки (хлорной извести).
9 вариант:
Как изменяется окраска пламени в зависимости от присутствия ионов щелочноземельных металлов. В чем заключается сущность наблюдаемого явления изменение окраски пламени. Где применяется данное явление?
Какую массу карбоната натрия необходимо добавить к 400 л воды, чтобы устранить жесткость, равную 3 м-экв?
Составьте уравнения реакций для осуществления следующих превращений:
Ca(OH)2 ® CaOCl2 ® CaCl2 ® Ca(NO3)2 ® CaCO3 ® CaCO3® CaO® CaC2 ® Ca(NO3)2 ® Ca(NO3)2
BaO2 + KMnO4 + H2SO4  ОВР
ОВР
О-1 восстановитель, Mn+7 окислитель.
10 вариант:
Какие природные материалы содержат s - элементы второй группы. напишите их формулы дайте им названия. биогенные функции s - элементов второй группы.
Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 9 м-экв. Какая масса гидрокарбоната кальция содержится в 500 л воды?
Составьте уравнения реакций для осуществленияследующих превращений:
BeO ® K2[Be(OH)4] ® Be(OH)2 ® BeO ® BeCl2 ® Be(NO3)2 ® Be(OH)2 ® BeO ® K2[Be(OH)4] ® Be(NO3)2.
BaO2 + FeSO4 + H2SO4  ОВР
ОВР
О-1 окислитель, восстановитель Fe +2.
 2015-10-16
2015-10-16 1740
1740
