Впоследствии были предложены технологии разделения на плотных носителях, среди которых особое место заняли гели. Последние сочетали удобства разделения в свободном растворе (в геле 95-99% воды) с возможностью фиксировать результаты электрофореза путем высушивания геля. Среди гелеобразующих веществ вначале получил признание крахмал, затем полисахариды из водорослей агар-агар (агароза) и наконец гели, искусственно получаемые путем полимеризации акриламида.
Полиакриламидный гель стал одним из наиболее популярных носителей для электрофореза. Полимеризацию проводят в буферном растворе. Затем гель помещают в электрофоретическую камеру, заполненную буферным раствором и содержащую электроды для образования электрического поля (рис.1.8). рН и другие параметры буферного раствора выбираются из расчета, чтобы разделяемые молекулы несли отрицательный заряд и двигались в электрическом поле слева направо. Поскольку разделяемые молекулы движутся в геле, те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к месту нанесения, чем меньшие.
|
|
|
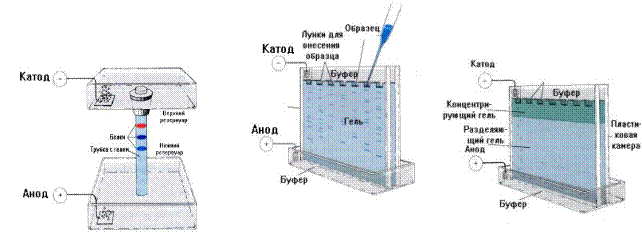
Рис.1.8. Виды проведения электрофореза в полиакриламидном геле (слева - в трубках с гелем, справа - в прямоугольных блоках)
Следует иметь ввиду, что этот метод позволяет разделять молекулы большей частью по их размеру, и совсем необязательно, - по их молекулярной массе. Для примера рассмотрим две молекулы белка по 1000 аминокислот каждая. Одна из них представляет вытянутую цепь (А), а вторая (за счет образования связей между соседними участками) имеет форму шпильки (Б):
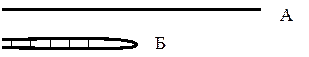
Поскольку они движутся внутри геля, обе молекулы будут вести себя как сферы, диаметр которых равняется длине вытянутой части молекулы. Обе молекулы имеют одинаковую молекулярную массу, однако благодаря тому, что вторичная структура Б де-лает её молекулу короче, чем А, быстрее будет передвигаться Б. Дабы устранить влияние различий по форме и оставить только различия по молекулярной массе, разделяемые молекулы должны иметь развернутую конформацию (без вторичной структуры). Для разрушения вторичной и третичной структуры используются различные методы подготовки препаратов белка.
Подготовка белков. Все белки обладают вторичной и третичной структурной организацией. При этом их молекулы не всегда несут отрицательный заряд в растворе. Для разрушения вторичной и третичной структуры и образования на поверхности белков отрицательного заряда их нагревают и обрабатывают детергентом – додецилсульфатом натрия (ДДС-натрий).
|
|
|
Если соблюсти вышеприведенные условия, разделение молекул при электрофорезе будет осуществляться в зависимости от их молекулярной массы. При этом удается, например, разделить 2 молекулы полинуклеотида, различающиеся на 1 мононуклеотид. Высокомолекулярные молекулы будут двигаться медленнее низкомолекулярных. Длина пройденного молекулой расстояния будет пропорциональна логарифму величины, обратной её молекулярной массе (log 1/MM). 
Обычно гели изображают в вертикальном положении, где место нанесения находится вверху, а движение разделяемых молекул направлено сверху вниз. Тогда в верхней части геля располагаются большие молекулы, а в нижней – с меньшей молекулярной массой.
Как правило, рядом с опытными пробами на гель наносится смесь белковых (или каких-то других разделяемых) молекул с известной молекулярной массой. Такие стандарты «молекулярной массы» позволяют прокалибровать пробег молекул. Тогда, зная какое расстояние прошло изучаемое вещество, можно установить его молекулярную массу. Ниже на рисунке 1.9 показан гель после обработки его красителем. Молекулы красителя связываются с каким-то определенным классом макромолекул независимо от последовательности расположения мономеров в их составе.
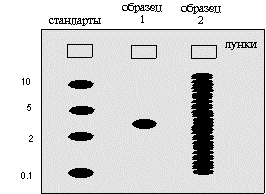
Рис.1.9. Результат проведения электрофореза в полиакриламидном геле после окраски геля неспецифическим красителем
Изображенный на рис.1.9 образец 1 содержит макромолекулы одного размера. Это может быть очищенный белок. При сравнении с подвижностью стандартов ясно, что молекулярная масса этого соединения около 3. Образец 2. Это может быть смесь белков после окраски геля неспецифическим красителем. Здесь находится так много полос, что среди них невозможно вычленить необходимую. В подобных условиях без зонда (который действует как специфический краситель) нам едва ли удастся получить полезную информацию об интересующем соединении. Учитывая это обстоятельство, для определения индивидуальных белков пользуются сочетанием электрофореза с иммунологическими реакциями (иммуноэлектрофорез) (рис.1.10).
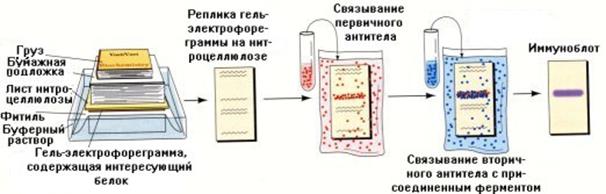
Рис.1.10. Схема проведения иммуноблот анализа для обнаружения белка после проведения электрофореза в полиакриламидном геле (описание этапов приведено в гл.13)
 2015-10-16
2015-10-16 4077
4077








