Очистка фермента начинается с выделения данного фермента из грубого клеточного экстракта, содержащего множество других компонентов. Небольшие молекулы удаляются диализом или гель-фильтрацией, нуклеиновые кислоты осаждаются путем добавления антибиотиков (стрептомицина) и т.д. Основная проблема—отделить нужный фермент от сотен химически и физически сходных белков. Если контроль за выделяемым белком доставляет довольно много хлопот исследователю, о присутствии фермента и его количестве на всех этапах очистки можно следить по его активности. В общем виде под активностью понимают количество фермента или биологического материла, содержащего фермент, которое при определенных условиях катализирует в единицу времени превращение определенного количества реагента, называемого субстратом. Активность - это изменение количества субстрата под влиянием фермента в единицу времени. Под изменением субстрата понимают снижающееся в единицу времени количество субстрата или же увеличивающееся количество продукта. Понятие "активность фермента" по сути дела идентична понятию "скорость ферментативной" реакции. Ферментативная активность выражается в единицах активности. В связи с существованием различных систем единиц исчисления введена интернациональная (стандартная) единица активности. Она носит символ "U" (unit-единица) и определяется как 1 мкмоль субстрата/мин. В системе СИ в качестве единицы ферментативной активности используют "катал" (kat). Катал определяется как 1 моль/сек.
1kat = 1 моль/сек.
Размерность её слишком велика, на практике пользуются меньшими кратными значениями, начиная с нанокатала (нкат). Это одна миллиардная катала или 10-9 кат. В сравнении с международной единицей следующее уравнение
1 U = 16,67 нкат
В практике лабораторий широко пользуются понятием удельная активность. Для этого число cтандартных единиц пересчитывают на какую-либо единицу сравнения. Это может быть мг белка в пробе или объем исследуемой биологической жидкости. Определение активности ферментов широко распространено в любой современной клинической лаборатории.
При исследовании кинетики реакций используется и такое понятие как молекулярная активность. Она показывает, сколько молекул субстрата в секунду превращаются в продукт 1 молекулой фермента и используется для сравнительной характеристики активности нескольких ферментов.
Пример вычисления активности фермента:
| Исходные данные: | Через 10 мин: | ||
| 25.0 x 10-3 моль л--1 пептида-субстрата, объем реакционной смеси 2.5 мл, 0.50 µг химотрипсина[4] | 18.6 x 10-3 моль л--1 пептида -субстрата, Объем реакционной смеси 2.5 мл, 0.50 µг химотрипсина. | ||
| Использованный субстрат | = 6.4 x 10-3 моль л-1 за 10 мин | ||
| Скорость реакции | = 6.4 x 10-4 моль л-1 мин-1 | ||
| Активность Фермента (скорость x объем) | = 6.4 x 10-4 моль л-1 мин-1 x 2.5 x 10-3 л = = 1.6 x 10-6 моль мин-1 | ||
| Удельная активность (активность / масса) | = 1.6 x 10-6 моль мин-1 / 0.50 µг = = 3.2 x 10-6 моль µг-1 мин-1 | ||
| Число оборотов (уд. акт. x молярная масса) | = 3.2 x 10-6 моль µг-1 мин-1 x 25,000 x 106 µг моль-1 = 8.0 x 104 мин-1 =1330 сек-1 | ||
Если удельная активность, рассчитанная выше, относится к чистому химотрипсину, образец, давший, например, удельную активность 2.0 x 10-7 моль µг-1 мин-1 - 100 % x 2.0 x 10-7 / 3.2 x 10-6 или 6.3 % чистоты. 1.0 µг такого образца на самом деле содержит лишь 0.063 µг химотрипсина и 0.937 µг примесей.
Методы исследования активности определяются механизмом реакции и природой опре
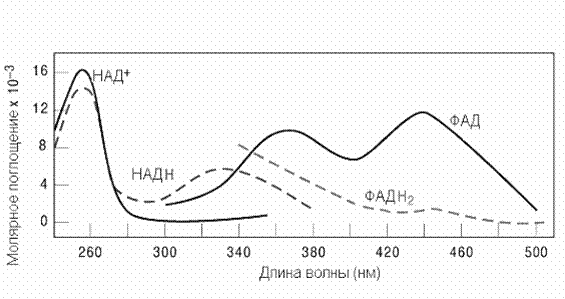
Рис2-4. Молярное поглощение НАД+,НАДН+Н+, ФАД, ФАДН2 при разных длинах волн поглощаемого света
деляемого вещества. Наиболее широко используются:
· Измерение изменения спектральных свойств (измерение поглощения света в видимой или ультрафиолетовой области, измерение флюоресценции) при помощи спектрофотометров, ФЭКов, спектрофлуориметров. Эти методы применяют и для определения количества продуктов или субстратов реакции, и для изменений количества коферментов, участвующих в реакции. Последнее нашло широкое применение в практике клинических биохимических лабораторий. В основе этих методов лежит закон Beer-Lambert: A = e x c x l = log (I0/I) (e, поглощение 1 M раствора вещества при специфической длине волны или молярный коэффициент экстинкции; c, концентрация; A, поглощение; l, длина в см кюветы спектрофотометра; I0, интенсивность падающего света; I, интенсивность прошедшего света). В случае, если молярный коэффициент экстинкции (e) исследуемого вещества неизвестен, исследователь определяет экспериментально зависимость между поглощением света исследуемого раствора и концентрацией этого вещества и использует полученную закономерность в форме стандартного (калибровочного) графика.
На рисунке 2-4 показаны спектральные характеристики коферментов НАД и ФАД в окисленной и восстановленной форме. Измерение поглощения при 340 нм используется для количественной оценки активности ферментов, катализирующих окислительно-восстановительные реакции c участием НАД. Вот пример такого расчета для реакции, катализируемой лактатдегидрогеназой В этой реакции молочная кислота окисляется, передавая водороды на НАД+. При этом НАД+ восстанавливается до НАДН +Н+., который в отличие от НАД+ поглощает свет с длиной волны 340 нм. Допустим, за время проведения реакции поглощение при длине волны 340 нм изменялось на 0.31 единицы в минуту. Измерения проводили в кювете шириной 1 см. Коэффициент молярной экстинкции для НАДН при 340 нм e = 6200 л моль-1 см-1.
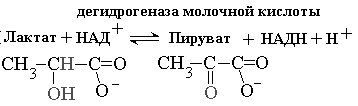
| Увеличение [НАДH] = | Увеличение поглощения e. l | 0.31 | =5.0 х10-5 моль/л |
Эту величину можно использовать для оценки скорости реакции.
· Измерение изменений концентрации высвобождаемых или поглощаемых во время реакции H+ или ОН- при помощи pH-стата (устройство, которое автоматически добавляет кислоту или основание, сохраняя постоянство pH в реагирующей смеси)
· Химический анализ с использованием высокоразрешающей жидкостной или газовой хроматографии, или ЯМР или тонкослойной хроматографии. (АТФазы)
· Изотопный анализ (например, с использованием радиоактивного 32P)
·
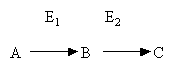 |
Сопряженные реакции – используются в случаях, если нет возможности прямо определить количество продукта исследуемой реакции. В таких случаях в реагирующую смесь добавляется фермент (Е2) катализирующий превращение образующегося продукта в реакции, которую можно оценить количественно, одним из вышеперечисленных методов.
Если фермент Е2 присутствует в избытке, скорость образования C отражает скорость образования В.
Например, сопряженное исследование активности глюкокиназы (используется избыток глюкозо-6-фосфат дегидрогеназы и НАДФ+)
Глюкоза + AТФ → глюкоза 6-Ф + AДФ: (катализируется глюкокиназой –Е1)
Глюкоза-6-Ф + НАДФ+ → 6-фосфоглюконолактон + НАДФН + H+ : (катализируется глюкоза-6Ф –дегидрогеназой – Е2):
Скорость образования НАДФH (измеряется по поглощению при 340 нм) пропорциональна активности глюкокиназы (см выше)
Классические методы очистки. Широко используются следующие методы очистки: осаждение различными концентрациями солей щелочно - земельных металлов (чаще всего сульфата аммония или сульфата натрия) или сочетанием их с органическими растворителями (ацетоном, этанолом), дифференциальная денатурация путем нагревания или изменения рН, дифференциалъное центрифугирование, гель-фильтрация и электрофорез.
Для быстрой очистки ферментов успешно применяется избирательная адсорбция и элюция белков с ионобменников (ДЭАЭ или КМ производные целлюлозы или других полимеров). Широко используется также: разделение белков по размерам при помощи гель-фильтрации. Все эти методы являются, однако, относительно мало избирательными (если они не используются в сочетании) для выделения индивидуального белка из сложной смеси клеточных ферментов.Значительно упрощается такая задача при помощи метода аффинной хроматографии.
| Табл 2-1. Типичная процедура очистки одного из ферментов печени | ||||
| Этапы очистки | Суммарная активность ед | Суммарный белок мг | Удельная активность ед/мг | Выход % |
| 1. Водно-солевой экстракт плаценты | 0.408 | (100) | ||
| 2. Осадок,образующийся после осаждения 65% -ным (NH4)2SO4 | 0.674 | 90.7 | ||
| 3. Осадок,образующийся после осаждения 35-65% -ным (NH4)2SO4 | 3.781 | 85.2 | ||
| 4. Активная фракция после хроматографии на ДЭАЭ-целлюлозе осадка фракции 3 | 8.252 | 78.5 | ||
| 5. Активная фракция после хроматографии фракции 4 на фосфоцеллюлозе | 59.1 | 58.4 | ||
| 6. Активная фракция после гель фильтрации фракции 5 | 110.8 | 227.2 | 53.4 | |
| 7. Повторение этапа 6. | 88.8 | 216.7 | 40.1 |
Типичная процедура очистки одного из ферментов печени с хорошим выходом и 227-кратной степенью очистки препарата описана в табл 2-1. Обратите внимание на изменение при очистке удельной актив н ости и выхода фермента. Процедура направлена на достижение максимальной удельной активности (число единиц активности фермента на 1 мг белка) при возможно большем выходе исходной суммарной активности. Из данных таблицы видно, что уже в процессе очистки решаются проблемы исследования свойств фермента. Повторение этапа 6 привело к снижению удельной активности, что возможно связано с особенностями физико-химических свойств выделяемого фермента.
 2015-10-16
2015-10-16 4988
4988








