Гидролиз сложных эфиров R1COOR2 в присутствии сильных кислот с образованием кислоты R1COOH и спирта R2OH является примером специфического кислотного катализа с участием ионов водорода.
|
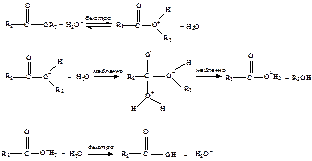 |
Первая стадия, связанная с внедрением протона в реагирующую часть молекулы сложного эфира, протекает быстро. Медленно происходит взаимодействие катиона с водой и отщепление молекулы спирта. Стадия, в которой образовавшийся катион R1COO+H2 отщепляет протон с образованием кислоты, протекает быстро.
Анализ представленного механизма реакции приводит к кинетическому уравнению вида:
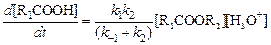 , (113)
, (113)
где [Х] – молярные концентрации соединений в момент времени t, моль/дм3.
Поскольку концентрация катализатора – ионов водорода практически постоянна и определяется начальной концентрацией сильной кислоты в реакционной смеси, выражение (114) упрощается и соответствует кинетическому уравнению реакции псевдопервого порядка:
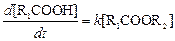 , (114)
, (114)
где 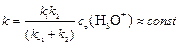 –
–
константа скорости реакции, зависящая от температуры и концентрации катализатора – ионов водорода, с-1×моль×дм-3;
с о(Н3О+) – исходная молярная концентрация сильной кислоты в системе, моль/дм3.
Изучение кинетики гидролиза сложного эфира в присутствии сильной кислоты предполагает периодический отбор проб реакционной смеси с их последующим химическим анализом. В ходе реакции происходит увеличение суммарной молярной концентрации кислот в смеси за счет образования карбоновой кислоты R1COOH.
Обозначим:
x – молярная концентрация R1COOH в момент времени t, моль/дм3;
а – исходная молярная концентрация сложного эфира, моль/дм3,
(а – x) – молярная концентрация сложного эфира в момент времени t от начала реакции, моль/дм3.
Следовательно, кинетическое уравнение (114) можно представить в виде:
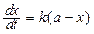 , (115)
, (115)
а его интегрирование дает расчетную формулу для константы скорости реакции:
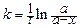 . (116)
. (116)
Для удобства вычислений последнее уравнение можно легко преобразовать, введя в него результаты химического анализа проб реакционной смеси.
По ходу протекания реакции проводят отбор аликвотных частей смеси (Vа, см3) и определяют в них суммарную молярную концентрацию эквивалента сильной и слабой кислот обычным титрованием стандартным раствором щелочи в присутствии фенолфталеина. Расчет проводят по формуле:
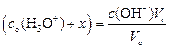 ,(117)
,(117)
где с (ОН-) – молярная концентрация эквивалента гидроксида натрия в титранте, моль/дм3;
Vt – объем титранта, пошедший на титрование аликвотной части Vа реакционной смеси, отобранной в момент времени t от начала реакции, см3;
с о(H3О+) – молярная концентрация эквивалента сильной кислоты, катализирующей гидролиз сложного эфира, моль/дм3;
x – молярная концентрация образовавшейся карбоновой кислоты R1COOH к моменту времени t, моль/дм3.
Фиксация состава реакционной смеси в момент отбора пробы достигается за счет резкого уменьшения скорости гидролиза в результате моментального снижения температуры анализируемой аликвотной части при внесении ее в предварительно охлажденную льдом дистиллированную воду.
Введем дополнительные обозначения:
V о – объем титранта, соответствующий началу реакции t = 0, когда x = 0, см3;
V ¥ – объем титранта после окончания реакции, когда весь сложный эфир полностью гидролизуется до карбоновой кислоты и спирта, что соответствует условию x = a.
С учетом уравнения (117) и введенных обозначений уравнение (116) преобразуется к виду:
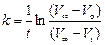 . (118)
. (118)
Оценку значения константы скорости реакции в этом случае удобно проводить с использованием линейной формы уравнения 118:
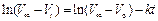 , (119)
, (119)
рассчитывая коэффициенты этого уравнения методом наименьших квадратов.
Этот способ наиболее удобен, поскольку позволяет обойтись без величины V о, определение которой в данном случае сопряжено с определенными погрешностями.
Для оценки энергии активации реакции гидролиза сложного эфира в кислой среде кинетические исследования проводят при двух температурах: при Т1 и Т2 (Т2 > Т1 ), по результатам эксперимента определяют две константы скорости k1 и k2 реакции гидролиза сложного эфира и далее с использованием соотношения, вытекающего из уравнения Аррениуса, рассчитывают энергию активации:
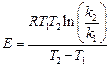 , (120)
, (120)
и стандартное отклонение измеренной косвенным методом физической величины:
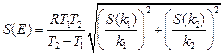 (121)
(121)
где Е – энергия активации реакции, Дж/моль;
R – универсальная газовая постоянная, равная 8.314 Дж/(моль×К);
T 1 и Т 2 – температуры протекания реакции, К;
k 1 и k 2 – константы скорости реакции при соответствующей температуре, с-1.
Выполнение измерений
1Приготовление раствора сильной кислоты
Готовят 350 см3 раствора хлороводородной или серной кислот (с о(Н+) – в таблице 9.1). Аликвотные части раствора сильной кислоты (с (Н+)» 1 моль/дм3) и дистиллированной воды отбирают в стакан мерным цилиндром.
Отбирают дважды по 10 см3 приготовленного раствора кислоты и титруют раствором гидроксида натрия (с 1(ОН-) = 0.2 моль/дм3).
Фиксируют объем раствора гидроксида натрия (Vo (ОН-), см3).
Рассчитывают молярную концентрацию эквивалента кислоты в растворе (с о(Н+), моль/дм3).
Таблица 9.1 – Молярная концентрация кислоты в исходных растворах
| Номер опыта | Молярная концентрация эквивалента кислоты | Номер опыта | Молярная концентрация эквивалента кислоты |
| с (Н+), моль/дм3 | с (Н+), моль/дм3 | ||
| 0.15 | 0.22 | ||
| 0.16 | 0.24 | ||
| 0.17 | 0,25 | ||
| 0.18 | 0.26 | ||
| 0.19 | 0.28 | ||
| 0.20 | 0.30 |
 2015-10-22
2015-10-22 1684
1684
