Готовят два стакана вместимостью 50 ¸ 100 см3.
В один из стаканов отбирают пипеткой 5 см3 рабочего раствора мурексида, а во второй – другой пипеткой 5 см3 приготовленного раствора кислоты. Раствор мурексида быстро вливают в стакан с раствором кислоты, в момент смешивания растворов включают секундомер – это начало реакции разложения мурексида. Приготовленную смесь быстро перемешивают, переносят в приготовленную кювету и затем помещают ее в кюветодержатель фотометра. Далее не менее 16 минут следят за изменением оптической плотности раствора (таблица 11.1), отмечая через каждые 2 минуты оптическую плотность раствора.
Замечание: в реакционной смеси молярная концентрация кислоты в два раза меньше исходной.
Таблица 11.1 – Результаты кинетических исследований реакции разложения мурексида в присутствии хлороводородной кислоты
| Время от начала реакции, t, мин | Молярная концентрация хлороводородной кислоты в исследуемом растворе, моль/дм3 | |||||
| с 1(НСl) = | с 2(НСl) = | с 3(НСl) = | ||||
| Оптическая плотность растворов | ||||||
| А 1 | ln A 1 | А 2 | ln A 2 | А 3 | ln A 3 | |
| … |
Расчет константы скорости реакции
Расчетный метод
Константу скорости реакции k, можно рассчитать по формуле:
 , (135)
, (135)
где [R]o – молярная концентрация индикатора в системе в начальный момент времени t = 0, моль/дм3;
[R] – молярная концентрация индикатора в системе в текущий момент времени t, моль/дм3;
t – время протекания реакции, с.
Так как оптическая плотность раствора А прямо пропорциональна молярной концентрации поглощающих частиц:
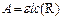 , (136)
, (136)
где e – молярный коэффициент погашения, дм3/(моль×см);
l – толщина поглощающего слоя раствора, см;
с (R) – молярная концентрация индикатора, моль/дм3,
формулу (135) можно записать:
 , (137)
, (137)
где А о – оптическая плотность раствора в начальный момент времени;
А – оптическая плотность раствора в текущий момент времени.
Таблица 11.2 – Константа скорости реакции при разных значениях
молярной концентрации ионов водорода
| Время от начала реакции, t, мин | Молярная концентрация хлороводородной кислоты в исследуемом растворе, моль/дм3 | ||
| с 1(НСl) = | с 2(НСl) = | с 3(НСl) = | |
| Константа скорости реакции, мин-1 | |||

| 
| 
| |
| … | |||

| |||

|
При расчете  одно значение
одно значение  , значительно отличающееся от остальных, можно не учитывать.
, значительно отличающееся от остальных, можно не учитывать.
 2015-10-22
2015-10-22 478
478








