Экспериментальные изотермы при различных температурах изображены на рис. 11.4. Как видно, с ростом температуры горизонтальные участки становятся все короче. При некоторой температуре прямолинейный отрезок исчезает и на изотерме остается лишь точка перегиба 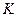 . Это означает, что исчезает переход из газообразного состояния в жидкое и наоборот, исчезает разница между жидким и газообразным.
. Это означает, что исчезает переход из газообразного состояния в жидкое и наоборот, исчезает разница между жидким и газообразным.
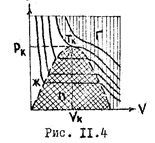 Это состояние называется критическим состоянием, а температура, при которой оно наступает - критической температурой
Это состояние называется критическим состоянием, а температура, при которой оно наступает - критической температурой 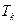 . Понятие критической температуры было введено Д. И. Менделеевым.
. Понятие критической температуры было введено Д. И. Менделеевым.
При температурах выше критической вещество может существовать только в газообразном состоянии и никакими способами не может быть переведено в жидкое.
Критической температуре 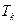 соответствует критическое давление
соответствует критическое давление 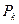 и критический объем
и критический объем 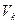 . Совокупность этих величин и характеризует критическое состояние. Так, например, для воды
. Совокупность этих величин и характеризует критическое состояние. Так, например, для воды 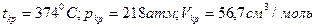 ; для углекислого газа
; для углекислого газа 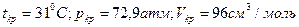 ; для водорода
; для водорода 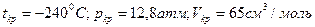 . Критические параметры
. Критические параметры 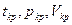 связаны с поправками
связаны с поправками 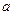 и
и  уравнения Ван-дер-Ваальса.
уравнения Ван-дер-Ваальса.
Уравнение (11.3), как говорилось, может иметь либо три действительных корня - ниже 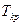 , либо один при
, либо один при 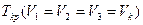 . Поэтому (11.3) можно в этом случае записать в виде:
. Поэтому (11.3) можно в этом случае записать в виде:
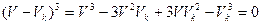
Сравнивая коэффициенты этого уравнения с (11.3) при одинаковых степенях, где 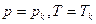 , получаем:
, получаем:
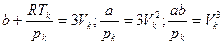 , откуда
, откуда
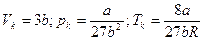 .
.
| Лекция 18 | Внутренняя энергия реального газа. Эффект Джоуля – Томсона и его физическая сущность. |
| Сжижение газов и получение низких температур. |
 2015-10-22
2015-10-22 497
497








