Для 1 моля идеального газа уравнение состояния имеет вид 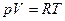 , где
, где 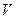 - объем, предоставленный молекулам газа. Для реальных газов некоторая его часть
- объем, предоставленный молекулам газа. Для реальных газов некоторая его часть  занята самими молекулами. Поэтому объем
занята самими молекулами. Поэтому объем 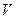 надо заменить разностью
надо заменить разностью  .
.
Учтем теперь взаимодействие молекул. Силы притяжения, действующие между молекулами, приводят, к уменьшению давления газа на стенки сосуда на некоторую величину 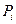 , так что:
, так что:
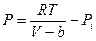 или
или 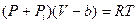 (11.1)
(11.1)
где 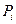 - дополнительное давление, обусловленное силами притяжения. Его называют также внутренним или молекулярным давлением. Это давление пропорционально концентрации молекул и силе, действующей на данную молекулу со стороны остальных, которая в свою очередь, также пропорциональна концентрации молекул. Таким образом,
- дополнительное давление, обусловленное силами притяжения. Его называют также внутренним или молекулярным давлением. Это давление пропорционально концентрации молекул и силе, действующей на данную молекулу со стороны остальных, которая в свою очередь, также пропорциональна концентрации молекул. Таким образом, 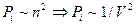 или
или 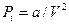 , где
, где 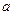 - постоянная, характеризующая силы молекулярного притяжения и зависящая от природы газа. Таким образом, получаем для 1 моля уравнение:
- постоянная, характеризующая силы молекулярного притяжения и зависящая от природы газа. Таким образом, получаем для 1 моля уравнение:
 (11.2)
(11.2)
Это уравнение состояния реального газа или уравнение Ван-дер-Ваальса; 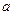 и
и  - константы, определяемые экспериментально. Исследуем уравнений (11.2), для чего перепишем его в виде:
- константы, определяемые экспериментально. Исследуем уравнений (11.2), для чего перепишем его в виде:
|
|
|
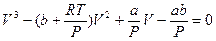 (11.3)
(11.3)
 С его помощью можно построить теоретические изотермы реального газа - зависимость
С его помощью можно построить теоретические изотермы реального газа - зависимость  от
от 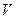 при заданных значениях
при заданных значениях  .
.
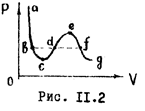
 Уравнение (11.3) - уравнение третьей степени относительно
Уравнение (11.3) - уравнение третьей степени относительно 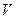 . Поэтому оно может иметь либо три действительных корня, либо один. Одна из таких изотерм изображена на рис. 11.2. На участках
. Поэтому оно может иметь либо три действительных корня, либо один. Одна из таких изотерм изображена на рис. 11.2. На участках 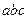 ,
,  , т.е. с увеличением давления объем уменьшается, на участке же
, т.е. с увеличением давления объем уменьшается, на участке же 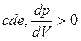 , что соответствует неестественному состоянию вещества, когда сжатие приводит к увеличению объема. Поэтому на опыта изотерма пожег быть лишь вида
, что соответствует неестественному состоянию вещества, когда сжатие приводит к увеличению объема. Поэтому на опыта изотерма пожег быть лишь вида 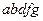 (Рис. 11.3). Такая изотерма действительно была получена Т. Эндрьюсом с углекислотой. Наличии горизонтального участка связано с тем, что при изменении объема вещество не может все время оставаться в однофазном состоянии. В некоторый момент происходит скачкообразной изменение состояния вещества и его распадение на две фазы: жидкую (
(Рис. 11.3). Такая изотерма действительно была получена Т. Эндрьюсом с углекислотой. Наличии горизонтального участка связано с тем, что при изменении объема вещество не может все время оставаться в однофазном состоянии. В некоторый момент происходит скачкообразной изменение состояния вещества и его распадение на две фазы: жидкую ( ) и газообразную (
) и газообразную (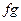 ). Горизонтальный участок (
). Горизонтальный участок (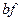 ) соответствует двухфазному состоянию вещества - переходу газа в жидкость при заданных температуре и давлении. Эта область насыщенного пара.
) соответствует двухфазному состоянию вещества - переходу газа в жидкость при заданных температуре и давлении. Эта область насыщенного пара.
| Лекция 17 | Изотермы реальных газов. Сравнение уравнения Ван-дер-Ваальса с экспериментальными данными. |
| Фазовые переходы 1-го и 2-го рода. Критическое состояние. |
 2015-10-22
2015-10-22 619
619








