Жесткость воды выражается суммой миллиэквивалентов ионов Са+2 и Мg+2, содержащихся в 1 л воды (мэкв/л). Один миллиэквивалент жесткости отвечает содержанию 20,04 мг/л Са+2 или 12,16 мг/л Мg+2.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2
Решение. В1 л воды содержится 202,5/500 = 0,405 г Са (НСО3)2,что составляет 0,405: 81 = 0,005 эквивалентных масс или 5 мэкв/л 81 г/моль - эквивалентная масса Са (НСО3)2. Следовательно, жесткость воды 5 мэкв.
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 мэкв?
Решение. Мольная масса CaSO4 136.14 г/моль; эквивалентная масса равна 136.14:2 = 68.07 г/моль. В 1 м3 воды жесткостью 4 мэкв содержится 4 • 1000 = 4000 мэкв. или 4000 • 68.07 = 272 280 мг = 272,280 г CaSO4.
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 мэкв?
Решение. В 500 л воды содержится 500 • 5 = 2500 мэкв солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 • 53 = 132500 мг =
=132,5 г соды (53 г/моль - эквивалентная масса Na2СО3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора НСl.
Решение: Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, т.е. нормальность, через х, составляем пропорция:
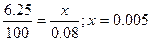 н.
н.
Таким образом, в 1 л исследуемой воды содержится 0.005 • 1000 = 5 мэкв гидро-карбоната кальция или 5 мэкв Ca+2 ионов. Карбонатная жесткость воды 5 мэкв. Приведенные примеры решают, применяя формулу
Ж=m/ЭV,
где т - масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг; Э - эквивалентная масса этого вещества; V- o6ъем воды. л.
Решение примера 1. Ж=m/ЭV=202500/81=5 мэкв. Эквивалентная масса Ca(HCO3)2
Равной половине его молярной массы.
Решение примера 2. Из формулы Ж=m/ЭV,m = 4*68,07*1000= 272280 мг = 272,280 г CaSO4.
Контрольные вопросы
341. Какую массу Na3PO4 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 мэкв? Ответ: 136,6 г.
342. Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жёсткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния? Ответ: 2 мэкв/л.
343. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08 н раствора HCl. Ответ. 6 мэкв/л.
344. В 1 л воды содержится ионов магния 36,47 мг и ионов кальция 50.1 мг. Чему равна жесткость этой воды? Ответ: 5.5 мэкв/л.
345. Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 мэкв. Ответ: 63.6 г.
346. Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв. Какая масса сульфата магния содержится в 300 л этой воды? Ответ: 126.3 г.
347. Вычислите жесткость воды. зная, что в 600 л ее содержится 65.7 г гидрокарбоната магния и 61,2 сульфата калия. Ответ: 3,2 мэкв/л.
348. В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды? Ответ: 0,83 мэкв/л.
349. Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 мэкв. Какой объем 0.1 н. раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды? Ответ: 3 см3.
350. В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. Ответ: 2,33 мэкв/л.
351. Вода содержащая только гидрокарбонат магния, имеет жесткость 3.5 мэкв. Какая масса гидрокарбоната магния содержится в 200 л этой воды? Ответ: 51,1 г.
352. К 1 м3 жесткой воды прибавили 132.5 г карбоната натрия. Насколько понизилась жесткость? Ответ: на 2 мэкв/л.
353. Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21.2 г карбоната натрия? Ответ: 8 мэкв/л.
354. Какая масса CaSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 мэкв? Ответ: 108,9 г.
355. Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 мэкв. Какая масса гидрокарбоната кальция содержится в 500 л воды? Ответ: 364,5 г.
356. Какие ионы надо удалить из природной воды, чтобы сделать воду мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций. Какую массу Са(ОН)2, надо прибавить к 2,5 л воды, чтобы устранить ее жесткость, равную 4,43 мэкв/л? Ответ: 0,406 г.
357. -Какую массу карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 мэкв? Ответ: 21,2 г.
358. К 100 л жесткой воды прибавили 12.95 г гидроксида кальция. Насколько понизилась карбонатная жесткость? Ответ: на 3.5 мэкв/л.
359. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0.292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? Ответ: 6,5 мэкв/л.
360. Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв? Ответ: 56,06 г.
p Элементы (…ns2np1-6)
Контрольные, вопросы
361. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al→Al2(SO4)3→Na[Al(OH)4]→Al(NO3)3,
362. Составьте электронные и молекулярные уравнения реакций: а) алюминия с раствором щелочи; б) бора с концентрированной азотной кислотой.
З6З. Какой процесс называется алюминотермией? Составьте электронные и молекулярные уравнения реакции, на которой основано применение термита (смесь Al и Fe3O4).
364. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
В→ Н3ВО3→ Na2В4О7→ Н3ВО3
Уравнение окислительно-восстановительной реакции составьте на основании электронных уравнений.
365. Какая степень окисления наиболее характерна для олова и какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
366. Чем можно объяснить восстановительные свойства соединений олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: a) SnCl2, с HgCl2; б) РbО2, с HCl конц.
367. Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
368. Какие соединения называются карбидами и силицидами? Напишите уравнения реакций: а) карбида алюминия с водой; б) силицида магния с хлороводородной (соляной) кислотой. Являются ли эти реакции окислительно-восстановительными? Почему?
369. На основании электронных уравнений составьте уравнение реакции фосфора с азотной кислотой, учитывая, что фосфор приобретает высшую, а азот степень окисления + 4.
370. Почему атомы большинства р- элементов способны к реакциям диспропорци-онирования (самоокисления - самовосстановления)? На основании электронных уравнений напишите уравнение реакции растворения серы в концентрированном растворе щелочи. Один из продуктов содержит серу в степени окисления +4.
371. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций H2SO4: а) с сероводородом; б) с хлором.
372. Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия растворе сероводорода: а) с хлором; б) с кислородом,
373. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций HNO2: а) с бромной водой; б) с HI.
374. Почему диоксид азота способен к реакциям самоокисления - самовосстановления (диспропорционирования)? На основании электронных уравнений напишите уравнение реакции растворения NO, в гидроксиде натрия.
375. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной — с медью. Укажите окислитель и восстановитель.
376. В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
377. Почему фосфористая кислота способна к реакциям самоокисления - самовосстановления (диспропорционирования)? На основании электронных уравнений составьте уравнение процесса разложения Н3 РО3 учитывая, что при этом фосфор приобретает низшую и высшую степени окисления.
378. В каком газообразном соединении фосфор проявляет свою низшую степень окисления? Напишите уравнения реакций: а) получения этого соединения при взаимодействии фосфида кальция с хлороводородной (соляной) кислотой; б) горения его в кислороде.
379. Какую степень окисления проявляют мышьяк, сурьма и висмут? Какая степень окисления является более характерной для каждого из них? Составьте электронные и молекулярные уравнения реакций: а) мышьяка с концентрированной азотной кислотой; б) висмута с концентрированной серной кислотой.
380. Как изменяются окислительные свойства галогенов при переходе от фтора к йоду и восстановительные свойства их отрицательно заряженных ионов? Почему? Составьте электронные и молекулярные уравнения реакций: a) Cl2+I2 +Н2О=; б) KI+Вr2=. Укажите окислитель и восстановитель.
381. Составьте электронные и молекулярные уравнения реакции, происходящей при пропускании хлора через горячий раствор гидроксида калия. К какому типу окислительно-восстановительных процессов относится данная реакция?
382. Какие реакции нужно провести дли осуществления следующих превращений:
NaCl→HCl→Cl2→КСlO3
Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
383. К раствору, содержащему SbCl3, и BiCl3, добавили избыток раствора гидроксида калия; Напишите молекулярные и ионно-молекулярные уравнения происходящих реакций. Какое вещество находится в осадке?
384. Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия хлороводородной (соляной) и разбавленной серной кислот? Что является окислителем в первом случае, что - в двух других? Приведите примеры.
385. Напишите формулы и назовите кислородные кислоты хлора, укажите степень окисления хлора в каждой из них. Какая из кислот более сильный окислитель? На основании электронных уравнений закончите уравнение реакции:
KI + NaOCl+H2SO4→ I2 +…
Хлор приобретает низшую степень окисления.
386. Какие реакции нужно провести, имея азот и воду, чтобы получить нитрат аммония? Составьте уравнения соответствующих реакций.
387. Какую степень окисления может проявлять кремний в своих соединениях?
Составьте уравнения реакций, которые надо провести для осуществления следующих превращай:
Mg2Si→ SiH4→SiO2→K2SiO3→H2SiO3
При каком превращении происходит окислительно-восстановительная реакция?
388. Какое применение находит кремний? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
SiO2→ Si→ K2SiO3→H2SiO3
Окислительно-восстановительные реакции напишите на основании электронных уравнений.
389. Как получают диоксид углерода в промышленности и в лаборатории? Напишите уравнения соответствующих реакций и реакций, с помощью которых можно осуществить следующие превращения:
NaHCO3→СО2→СаСО3→Са(НСО3)2
390. Какие и солей угольной кислоты имеют наибольшее промышленное применение? Как получить соду, исходя из металлического натрия, хлороводородной (соляной) кислоты, мрамора и воды? Почему в растворе соды лакмус приобретает синий цвет? Ответ подтвердите составлением уравнений соответствующих реакций.
d-Элементы (... (n-1) d 1-10ns0-2)
Контрольные вопросы
391. Серебро не взаимодействует с разбавленной серной кислотой, тогда как, в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения соответствующей реакции.
392. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Сu→ Cu(NO3)2→ Сu(ОН)2→СuCl2→[Cu(NH3)4] Cl2
393. Составьте электронные и молекулярные уравнения реакций цинка: а) c раствором гидроксида натрия б) с концентрированной серной кислотой, учитывая восстановление серы до нулевой степени окисления.
394. Составьте уравнения реакций, которые надо провести для осуществления
Аg→АgNО3→AgCl→[Ag(NH3)2]Cl→ AgCl
395. При постепенном прибавлении раствора KI к раствору Hg(NO3)2, образующийся вначале осадок растворяется. Какое комплексное соединение при атом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
396. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Cd→Cd(NO3)2→ Cd(OH)2→[Cd(NH3)6](OH)2→CdSO4
397. При сливании растворов нитрата серебра и цианида калия выпадает осадок, который который легко растворяется в избытке KCN. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
398. К какому классу соединений относятся вещества, полученные при действии избытка гидроксида натрия на растворы ZnCl2,. CdCl2, HgСl2? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
399. При действии на титан концентрированной хлороводородной (соляной) кислотой образуется трихлорид титана, а при действии азотной — осадок метатитановой кислоты. Составьте электронные и молекулярные уравнения соответствующих реакций.
400. При растворении титана в концентрированной серной кислоте последняя восстанавливается минимально, а титан переходит в катион с высшей степенью окисления. Составьте электронные и молекулярное уравнения реакции.
401. Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Иодид калия восстанавливает ионы меди (II) в соединения меди со степенью окисления +1. Составьте электронные и молекулярные уравнение взаимодействия KI с сульфатом меди.
402. Диоксиды титана и циркония при сплавлении взаимодействуют со щелочами. О каких свойствах оксидов говорят эти реакции? Напишите уравнения реакций между: а) TiО2 и ВаО; б) ZrO2 и NaOH. В первой реакции образуется метатитанат, а во второй — ортоцирконат соответствующих металлов.
403. На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты, гидроксида натрия и аммиака. Какие соединения цинка и кадмия образуются в каждой из этих реакций? Составьте молекулярные и ионно-молекулярные уравнения реакций?
404. Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом высшую степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
405. В присутствии влаги и диоксида углерода медь окисляется и покрывается зеленым налетом. Как называется и каков состав образующегося соединения? Что произойдет, если на него подействовать хлороводородной (соляной) кислотой? Напишите уравнения соответствующих реакций. Окислительно-восстановительную реакцию составьте на основании электронных уравнений.
406. Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой — избыток раствора щелочи. Какие соединения цинка и меди образуются при этом? Составьте уравнения соответствующих реакций.
407. Ванадий получают алюминотермически или калцийтермически восстановлением оксида ванадия (V) V2 О5,. Последний легко растворяется с образованием метаванадатов. Напишите уравнения соответствующих реакций. Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.,
408. Азотная кислота окисляет ванадий до метаванадиевой кислоты. Составьте электронные и молекулярные уравнения реакции.
409. Какую стернь окисления проявляет ванадий в соединениях? Составьте формулы оксидов ванадия, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов ванадия, при переходе от низшей к высшей степени окисления. Составьте уравнения реакций: a) V2O3 с H2SO4; б) V2О5 с NaOH.
410. При внесении цинка в подкисленный серной кислотой раствор метаванадата аммония NH4 VO3 желтая окраска постепенно переходит в фиолетовую за счет образования сульфата ванадия (II). Составьте электронные и молекулярные уравнения реакции.
411. Хромит калия окисляется бромом в щелочной среде. Зеленая окраска раствора переходит желтую. Составьте электронные и молекулярные уравнения реакции, - какие ионы обусловливают начальную и конечную окраску раствора?
412. Составьте электронные и молекулярные уравнения реакций: а) растворения молибдена в азотной кислоте; б) растворения вольфрама в щелочи в присутствии кислорода. Учтите, что молибден и вольфрам приобретают высшую степень окисления.
413. При сплавлении хромита железа Fe(CrO2)2 с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают соответственно степени окисления +6 и +3. Составьте электронные и молекулярные уравнения реакции.
414. К подкисленному серной кислотой раствору дихромата калия прибавили порошок алюминия. Через некоторое время оранжевая окраска раствора перешла в зеленую. Составьте электронные и молекулярное уравнения реакции.
415. Хром получают методом алюминотермии из его оксида (III), а вольфрам — восстановлением оксида вольфрама (VI) водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
416. Составьте уравнения реакций, которые надо провести для осуществления превращений:
Na2Cr2O7→ Na2CrO4→ Na2Cr2O7→CrCl3→ Cr(OH)3
Уравнение окислительно-восстановительной реакции напишите на основании электронных уравнений.
417. Марганец азотной кислотой окисляется до низшей степени окисления, а рений приобретает высшую степень окисления. Какие соединения при этом получаются?
Составьте электронные и молекулярные уравнения соответствующих реакций.
418. Хлор окисляет перманганат калия К2МnО4. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения реакции.
419. Как меняется степень окисления марганца при восстановлении KMnO4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакции между КМnО4 и KNO2, в нейтральной среде.
420. На основании электронных уравнений составьте уравнение реакции получения манганата калия К2МnО4 сплавлением оксида марганца (IV) с хлоратом калия КСlO3 в присутствии гидроксида калия. Окислитель восстанавливается максимально, приобретая низшую степень окисления.
421. Почему оксид марганца (IV) может проявлять и окислительные, и восстановительные свойства? Исходя из электронных уравнений, составьте уравнение реакций:
а) МnО2 + КI + H2S04 =; б) МnО2 + КNО3 + КОН=
422. Для получения хлора в лаборатории смешивают оксид марганца (IV) с хлоридом натрия в присутствии концентрированной серной кислоты. Cоставьте электронные и молекулярное уравнения этой реакции.
423. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe→ FеSО4→ Fe(OH)2→ Fe(OH)3→ FeCl3
424. Какую степень окисления проявляет железо в соединениях? Как можно обнаружить ионы Fe2+ и Fe3+ в растворе? Составьте молекулярные и ионно-молекулярные уравнения реакций.
425. Чем отличается взаимодействие гидроксидов кобальта (III) и никеля (III) с кислотами от взаимодействия гидроксида железа (III) с кислотами? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
426. Могут ли в растворесуществовать совместно следующие вещества: FeCl3 и SnCl2 б)FeSO4 и NaOH; в) FeCl3 и K3[Fe(CN)6]? Для взаимодействующих веществ составьте уравнения реакций.
427. Составьте уравнения реакций, которые надо провести для осуществления превращений:
Ni→Ni(NO3)2→Ni(OH)2→ Ni(OH)3→ NiCl2
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
428. Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; 6) взаимодействия осмия с фтором. Платина окисляется до степени окисления +4, а осмий — до +8.
429. Составьте молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe→ FeCl2→ Fe(CN)2→ K4[Fe(CN)6]→K3[Fe(CN)6]
К окислительно-восстановительным реакциям составьте электронные уравнения.
430. Феррат калия K2FeO4 образуется при сплавлении Fe2O3 с калийной селитрой КNО3 в присутствии КОН. Составьте электронные и молекулярное уравнения реакции.
 2015-10-22
2015-10-22 997
997








