Скорость химической реакции — изменение количества вещества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции:

выражение для скорости будет выглядеть так:

Гомогенной называется система, состоящая из одной фазы, гетерогенной – система, состоящая из нескольких фаз.
Пример гомогенной системы – любая газовая смесь (смесь азота с кислородом).
Пример гетерогенной системы – вода со льдом, насыщенный раствор с осадком, уголь и сера в атмосфере воздуха…
Скорость гомогенной реакции называется кол-во вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единицы объема системы.
Скорость гетерогенной реакции называется кол-во вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
Скорость реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящие за единицу времени.
Бывают случаи, когда реакция происходит в результате одновременного столкновения трех частиц. Например, для реакции 2А + Б = В (или 2А + Б = В + Г +…) кинетическое уравнение должно выглядеть так:
v = k[А][А][Б] или v = k[А]2[Б]
В общем случае, для реакции
aA +bB + cC = dD + eE + fF + …
кинетическое уравнение для скорости реакции записывается следующим образом:
v = k[A]a[B]b[C]c (3)
Оно представляет собой произведение концентраций реагентов, каждая из которых взята в степени, равной числу молей соответствующего вещества в полном уравнении реакции. Это не что иное, как математическая запись ЗАКОНА ДЕЙСТВИЯ МАСС.
КОНСТАНТА РАВНОВЕСИЯ величина, определяющая для данной хим. р-ции соотношение между термодинамич. активностями исходных в-в и продуктов в состоянии хим. равновесия.
 В общем случае
В общем случае
где vi и v'j – коэффициенты исходных в-в Аi (i=1,2,..., q) и продуктов р-ции А'j (j=1, 2,..., r), активности к-рых соотв.  , константа равновесия
, константа равновесия 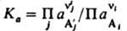 .
.
 2015-10-22
2015-10-22 6628
6628
