Задание 1. Рассчитайте молярную массу эквивалентов элемента Мэ в соединениях (табл. 17).
Таблица 17
Исходные данные
| Вариант | Элемент | Соединения | Вариант | Элемент | Соединения |
| S | 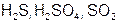 | S | 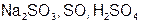 | ||
| Mn | 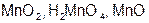 | Mn | 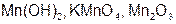 | ||
| P |  | P |  | ||
| Fe | 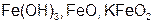 | Fe | 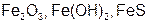 | ||
| N | 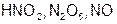 | N |  | ||
| Cl |  | Cl | 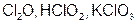 |
Окончание табл. 17
| Вариант | Элемент | Соединения | Вариант | Элемент | Соединения |
| Cr |  | Cr | 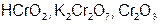 | ||
| Br | 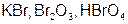 | Br | 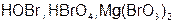 | ||
| I | 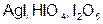 | I | 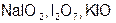 | ||
| Se | 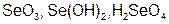 | Se | 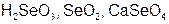 | ||
| As | 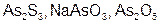 | As | 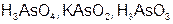 | ||
| B | 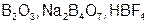 | B | 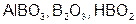 | ||
| C |  | C | 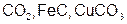 | ||
| Сr | 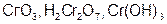 | W | 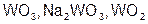 | ||
| Mo |  | Сu | 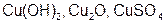 |
Задание 2. Рассчитайте молярные массы эквивалентов (Мэ) следующих веществ, при условии, что в кислоте замещаются все атомы водорода, а у основания замещаются все группы (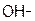 ) (табл. 18).
) (табл. 18).
Таблица 18
Исходные данные
| Вариант | Соединения | Вариант | Соединения |
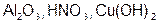 | 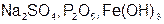 | ||
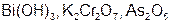 | 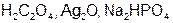 | ||
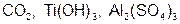 | 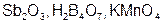 | ||
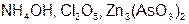 | 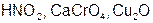 | ||
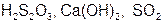 | 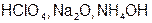 | ||
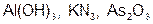 | 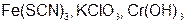 | ||
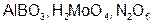 | 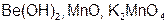 | ||
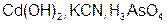 | 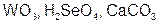 | ||
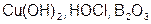 | 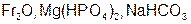 | ||
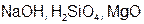 |  | ||
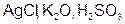 | 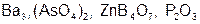 | ||
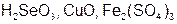 | 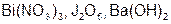 | ||
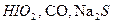 | 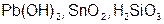 | ||
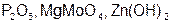 | 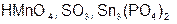 | ||
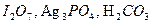 |  |
Задание 3. Решите задачу своего варианта (табл. 19).
Таблица19
Исходные данные
| Вариант | Условия |
| Определите молярную массу эквивалентов магния, если известно, что при сгорании 4,56 г его образуется 7,56 г оксида магния. | |
| В хлориде меди (II) содержится 47,26 % меди. Зная, что молярная масса эквивалентов хлора равна 35,46 моль, определите молярную массу эквивалентов меди в этом соединении. | |
| Определите молярную массу эквивалентов серной кислоты, если известно, что 98,08 г ее реагируют с 24,32 г магния, молярная масса эквивалентов которого – 12,16 моль. | |
| При разложении нагреванием 0,2318 г оксида металла получено 0,2158 г металла. Определите молярную массу эквивалентов металла. | |
| На нейтрализацию 0,5358 г кислоты потребовалось 0,5 г щелочи, молярная масса эквивалентов которой равна 56,11 моль. Какова молярная масса эквивалентов кислоты? | |
| При сгорании 5 г металла образуется 9,44 г оксида металла. Определите молярную массу эквиваленов металла. | |
| Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из галогенов. Определите молярную массу эквивалентов галогена. | |
| Масса 1 л (дм3) кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, молярная масса эквивалентов которого равен 12 г/моль. | |
| Определите молярные массы эквивалентов металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида. | |
| При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найдите молярную массу эквивалентов железа и его эквивалент, если известно, что молярная масса эквивалентов серы равна 16 г/моль. | |
| Вычислите атомную массу двухвалентного металла и определите, какой это металл, если 8,34 г металла окисляются 0,68 л кислорода (н.у.). | |
| Мышьяк образует два оксида, из которых один содержит 65,2 % (масс.) As, а другой – 75,7% (масс.) As. Определите молярные массы эквивалентов мышьяка в обоих случаях. | |
| 1 г некоторого металла соединяется с 8,89 г брома и с 1,78 г серы. Найдите эквивалентные массы брома и металла, зная, что молярная масса эквивалентов серы равна 16 г/моль. | |
| Определите массу гидросульфата натрия, образующегося при нейтрализации серной кислотой раствора, содержащего 8 г гидроксида натрия. | |
| Молярная масса эквивалентов хлора равна 35,5 г/моль, молярная масса атомов меди равна 63,5 г/моль. Молярная масса эквивалентов хлорида меди равна 99,5 г/моль. Какова формула хлорида меди? | |
| Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определите молярную массу эквивалентов металла и объем выделившегося водорода (н.у.). | |
| На восстановление 1,8 г оксида металла израсходовано 883 см3 водорода (н.у.). Вычислите молярную массу эквивалентов оксида и металла. |
Окончание табл. 19
| Вариант | Условия |
| Некоторое количество металла, молярная масса эквивалентов которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла. | |
| Некоторое количество металла, молярная масса эквивалентов которого равна 27,9 г/моль, вытесняет из кислоты 700 см3 водорода (н.у.). Определите массу металла. | |
| 0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 дм3 водорода (н.у.). Определите молярный объем эквивалентаводорода, зная, что молярная масса эквивалентов алюминия равна 8,99 г/моль. | |
| При взаимодействии 5,95 г некоторого вещества с 2,75 г хлороводорода получилось 4,4 г соль. Вычислите молярные массы эквивалентов вещества и образовавшейся соли. | |
| 1,6 г кальция и 2,61 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислите молярную массу эквивалентов цинка, зная, что молярная масса эквивалентов кальция равна 20 г/моль. | |
| В какой массе гидроксида натрия содержится то же количество эквивалентов, что и в 140 г гидроксида калия? | |
| Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалентов этого металла. | |
| Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалентов этого металла. | |
| Вычислите молярную массу эквивалентов металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 дм3 водорода (н.у.). | |
| В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалентов металла и его оксида. | |
| Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалентов этого металла. | |
| При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида. | |
| При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалентов металла. |
Тестовые задания
1. Для расчета фактора эквивалентности вещества Н2СО3 используют число:
а) замещаемых ионов водорода
б) отдаваемых электронов
в) принимаемых электронов
г) равное валентности углерода
2. При нормальных условиях масса водорода, занимающего объем 44,8 дм3 равна, г:
а) 1
б) 2
в) 4
г) 8
3. Количество молекул, содержащихся в 10 моль углекислого газа, составляет:
а) 1,204 · 1023
б) 6,023 · 1023
в) 12,04 · 1024
г) 6,023 · 1024
4. Молярная масса эквивалентов азотной кислоты равна величине (г/моль):
а) 63
б) 31,5
в) 126
г) 189
5. Молярная масса эквивалентов гидроксида кальция равна величине (г/моль):
а) 74
б) 37
в) 111
г) 18,5
6. Молярная масса эквивалентов карбоната кальция равна величине (г/моль):
а) 50
б) 100
в) 25
г) 200
7. Единица измерения молярной массы эквивалента:
а) г/моль;
б) моль/г;
в) безмерная величина;
г) г/дм3.
8. При расчете М(1/zСu(OH)2) величина z в реакции 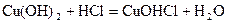 равна:
равна:
а) 1
б) 2
в) 3
г) 4
9. При расчете М(1/zН3РО4) величина z в реакции 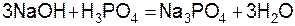 равна:
равна:
а) 1
б) 2
в) 3
г) 4
10. Название наименьшей частицы химического элемента, сохраняющей все его химические свойства:
а) протон
б) атом
в) электрон
г) ион
 2015-10-22
2015-10-22 2046
2046








