● Атомно-молекулярное учение о строении вещества
Атомно-молекулярное учение о строении вещества М.В. Ломоносова является одной из основ научной химии. Всеобщее признание атомно-молекулярная теория получила в начале ХIХ в. После утверждения в химии атомистики Дальтона. С тех пор главным объектом исследования химии стали молекулы. Основные положения этого учения были изложены в 1741 г. в работе «Элементы математической химии»:
– большинство веществ состоят из молекул; молекулы различных веществ отличаются между собой химическим составом, размерами, физическими и химическими свойствами;
– молекулы находятся в непрерывном движении; между ними существует взаимное притяжение и отталкивание. Скорость и характер движения молекул зависит от агрегатного состояния веществ. Тепловое состояние тел есть результат движения их частиц;
– при физических явлениях состав молекул остается неизменным, при химических – они претерпевают качественные и количественные изменения и из одних молекул образуются другие;
– молекулы состоят из атомов, при химических реакциях атомы в отличие от молекул не претерпевают качественных изменений.
● Химический элемент. Атомная и молекулярная масса. Моль
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства.
Элемент – это вид атомов с одинаковым зарядом ядра.
Молекула – нейтральная наименьшая совокупность атомов, обладающая определенным составом и структурой, и, как следствие, определенными физическими и химическими свойствами. Это наименьшая частица вещества.
Важной характеристикой атома является его атомная масса, абсолютная величина очень мала, поэтому для практических целей пользуются относительной атомной массой.
Относительная атомная масса 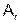 – это масса атома, выраженная в атомных единицах массы, она показывает, во сколько раз масса атома данного элемента тяжелее 1/12 атома углерода 12С.
– это масса атома, выраженная в атомных единицах массы, она показывает, во сколько раз масса атома данного элемента тяжелее 1/12 атома углерода 12С.
1 а.е.м. = 1/12 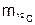 = 1/12×1,9927×10–23 = 1,66057 ×10–24 г.
= 1/12×1,9927×10–23 = 1,66057 ×10–24 г.
Относительная молекулярная масса 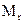 вещества– масса молекулы, выраженная в атомных единицах массы.
вещества– масса молекулы, выраженная в атомных единицах массы.
В химии с единицами массы и объема применяется единица количества вещества – моль.
Моль – это количество вещества, содержащее столько формульных единиц, сколько атомов содержится в 12 г изотопа углерода 12С.При использовании термина «моль» следует указывать частицы (моль молекул, атомов и т. д.).
□ Количество частиц в 1 моле любого вещества одно и то же и равно 6,02×1023. Это число называется числом Авогадро и обозначается 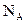 .
.
□ Количество молей вещества nx – это физическая величина, пропорциональная числу структурных единиц этого вещества.
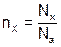
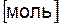 , (1)
, (1)
где, 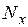 – число частиц вещества;
– число частиц вещества; 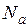 – число Авогадро.
– число Авогадро.
Молярная масса 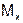 – масса одного моля вещества, численно она равна отношению массы вещества к количеству.
– масса одного моля вещества, численно она равна отношению массы вещества к количеству.
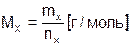 , (2)
, (2)
где 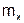 – масса вещества, г;
– масса вещества, г; 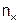 – количество вещества, моль.
– количество вещества, моль.
Необходимо различать молярную массу 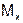 и молекулярную массу
и молекулярную массу 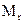 , выраженную в а.е.м. Если молярная масса
, выраженную в а.е.м. Если молярная масса 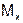 выражена г/моль, то численные значения их равны, если молярная масса в кг/моль, то значение в 1000 раз меньше.
выражена г/моль, то численные значения их равны, если молярная масса в кг/моль, то значение в 1000 раз меньше.
Пример: молекулярная масса соляной кислоты (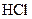 ) составляет
) составляет
36,5 а.е.м., а ее молярная масса 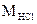 – 36,5 г/моль или 36,5×10–3 кг/моль.
– 36,5 г/моль или 36,5×10–3 кг/моль.
● Основные стехиометрические законы
Закон сохранения массы (М.В. Ломоносов, 1748 г., А.Л. Лавуазье 1780) служит основой при расчете материального баланса химических процессов: масса веществ, вступивших в химическое взаимодействие всегда равна массе образовавшихся веществ.
Закон является материальной основой для составления химических уравнений, подбора стехиометрических коэффициентов и расчетов по ним.
Закон кратных отношений (Дж. Дальтон, 1803)
Если два элемента образуют друг с другом несколько различных соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.
Открытие закона кратных отношений явилось одним из наиболее убедительных свидетельств правильности атомно-молекулярной теории строения вещества. Закон кратных отношений – один из законов стехиометрии, строго выполняется для стабильных газообразных соединений. Для многих кристаллических соединений наблюдаются отклонения от кратных отношений закона.
Закон постоянства состава (Ж.Л. Пруст, 1808).
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен. Закон является материальной основой для определения признаков индивидуальных веществ и дает возможность использовать формулы для описания состава соединений.
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению советского физика-химика Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Д. Дальтона), вторые – бертоллидами (в память французского химика К.Л. Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например 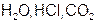 . Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Состав соединений молекулярной структуры, т.е. состоящих из молекул, является постоянным независимо от способа получения.
Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Закон Авогадро. В равных объемах различных газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул. Впоследствии это число было названо числом (константой) Авогадро, Na = 6,022·1023 моль–1.
Следствия из закона Авогадро:
1 моль любого вещества содержит 6,0221·1023 число молекул.
1 моль любого газа при одинаковых условиях занимает один и постоянный объем. Это объем при нормальных условиях (н. у), т. е.
Т = 273 К и р = 101,3 кПа равен 22,4 л/моль (дм3/моль). Данный объем называется молярным.
Молярный объем 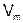 – это отношение объема вещества к количеству моль этого вещества.
– это отношение объема вещества к количеству моль этого вещества.
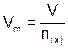 = 22,4 дм3/моль, (3)
= 22,4 дм3/моль, (3)
где 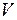 – объем вещества, дм3;
– объем вещества, дм3; 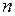 – количество вещества, моль.
– количество вещества, моль.
● Эквивалент. Закон эквивалентов
Эквивалент (Э) – это реальная ли условная частица вещества, которая может присоединять, замещать, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
При определении эквивалента вещества необходимо исходить из конкретной реакции.
Например: Из уравнения реакции 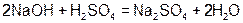 .
.
Следует, что одному иону водорода соответствует одна молекула 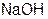 и одна
и одна 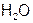 ,
, 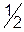 молекулы
молекулы 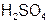 и
и 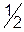 молекулы
молекулы 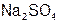 , поэтому Э(
, поэтому Э(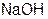 )=
)= 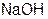 , Э(
, Э(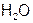 )=
)= 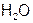 (это реальные частицы); Э(
(это реальные частицы); Э(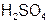 )=
)= 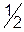
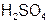 , Э(
, Э(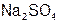 )=
)= 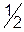
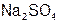 (это условные частицы).
(это условные частицы).
Моль эквивалентов – количество вещества, содержащего 6,022×1023 эквивалентов. Масса одного моля эквивалентов вещества (элемента) называют молярной массой эквивалентов вещества 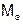 , г/моль.
, г/моль.
Например:
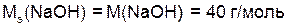 ;
;
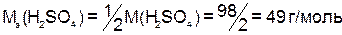 ;
;
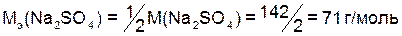 .
.
Число, обозначающее какая доля от реальной частицы эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях, называют фактором эквивалентности fэ.
Например: Врассмотренных примерах: fэ(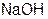 ) = 1; fэ(
) = 1; fэ(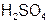 ) =
) = 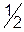 ; fэ(
; fэ(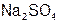 ) =
) = 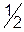 .
.
Закон эквивалентов (И.В. Рихтер, 1809)
Химические элементы или вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
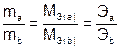 , (4)
, (4)
где 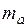 и
и 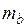 – массы веществ, г;
– массы веществ, г; 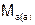 и
и 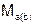 – молярные массы эквивалентов веществ, г/моль;
– молярные массы эквивалентов веществ, г/моль; 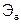 и
и 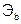 – эквиваленты веществ, моль.
– эквиваленты веществ, моль.
Если одно из веществ или оба вещества, вступивших или получившихся в результате реакции, находится в газообразном состоянии, закон эквивалентов принимает вид:
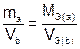 или
или 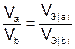 , (5)
, (5)
где 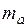 – масса твердого или жидкого вещества, г;
– масса твердого или жидкого вещества, г; 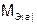 – молярная масса эквивалента твердого (жидкого) вещества, г/моль;
– молярная масса эквивалента твердого (жидкого) вещества, г/моль; 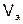 ,
, 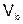 – объем газообразного вещества (н.у.), л;
– объем газообразного вещества (н.у.), л; 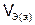 ,
, 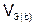 – молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
– молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
Молярный объем эквивалента вещества 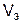 – это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
– это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
Поскольку 1 моль любого газа при нормальных условиях занимает объем 22,4 л, то молярный объем эквивалента газообразного водорода будет равняться 11,2 л/моль, а кислорода – 5,6 л/моль.
Молярная масса эквивалентов элемента в соединении не является величиной постоянной. Она зависит от валентности элемента в данном соединении и выражается, 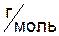 , уравнением:
, уравнением:
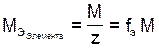 , (6)
, (6)
где 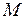 – молярная масса элемента, г/моль;
– молярная масса элемента, г/моль; 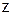 – валентность элемента в данном соединении; fэ – фактор эквивалентности.
– валентность элемента в данном соединении; fэ – фактор эквивалентности.
Молярные массы эквивалентов сложных веществ рассчитываются,  , по следующим формулам:
, по следующим формулам:
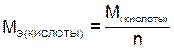 , (7)
, (7)
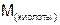 – молярная масса кислоты,
– молярная масса кислоты,  ;
; 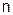 – число атомов водорода вступивших в реакцию.
– число атомов водорода вступивших в реакцию.
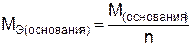 , (8)
, (8)
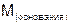 – молярная масса основания,
– молярная масса основания, 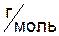 ;
; 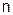 – число гидроксильных групп в основании, вступивших в реакцию.
– число гидроксильных групп в основании, вступивших в реакцию.
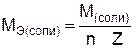 , (9)
, (9)
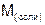 – молярная масса соли,
– молярная масса соли, 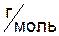 ;
; 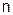 – число атомов металла образующего соль;
– число атомов металла образующего соль; 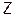 – валентность металла.
– валентность металла.
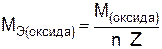 , (10)
, (10)
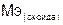 – молярная масса оксида;
– молярная масса оксида; 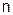 – число атомов элемента образующего оксид;
– число атомов элемента образующего оксид; 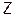 – валентность этого элемента.
– валентность этого элемента.
 2015-10-22
2015-10-22 2537
2537








