Пример 1. Рассчитайте молярную массу эквивалентов серы в соединениях  .
.
Решение. Расчет ведем по формуле (6):
а) SO2 – оксид серы, валентность серы в данном соединении равна 4
МЭ(S) = 32/ 4 = 8 г/моль;
б) H2SO4 – серная кислота, валентность серы в данном соединении равна 6
МЭ(S) = 32/ 6 = 5,33 г/моль;
в) H2S – сероводород, валентность серы в данном соединении равна 2
МЭ(S) = 32/ 2 = 16 г/моль.
Пример 2. Рассчитайте молярные массы эквивалентов (Мэ) следующих веществ: 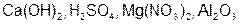 .
.
Решение.  – гидроксид кальция, основание. Расчет ведем по формуле (8)
– гидроксид кальция, основание. Расчет ведем по формуле (8)
 = 40 + 2·(16 + 2) = 76 г/моль.
= 40 + 2·(16 + 2) = 76 г/моль.
Так как в молекуле  имеются две гидроксидные группы (ОН), то в случае замещения в реакции одной из них n= 1,
имеются две гидроксидные группы (ОН), то в случае замещения в реакции одной из них n= 1,  = 76/1 = 76 г/моль, а двух n= 2,
= 76/1 = 76 г/моль, а двух n= 2,  ) = 76/ 2 = 38 г/моль.
) = 76/ 2 = 38 г/моль.
 – серная кислота. Расчет ведем по формуле (7)
– серная кислота. Расчет ведем по формуле (7)
 = 2 + 32 + 16·4 = 98 г/моль,
= 2 + 32 + 16·4 = 98 г/моль,
Так как в кислоте два атома водорода, то в случае замещения одного n= 1, 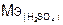 = 98/1 = 98 г/моль,
= 98/1 = 98 г/моль,
а двух n= 2, 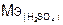 ) = 98/ 2 = 49 г/моль.
) = 98/ 2 = 49 г/моль.
 – нитрат магния, соль. Расчет ведем по формуле (9)
– нитрат магния, соль. Расчет ведем по формуле (9)
 = 24 + 2·(14 + 16·3) = 148 г/моль; n= 1 (количество атомовнов металла), Z = 2 (валентность металла)
= 24 + 2·(14 + 16·3) = 148 г/моль; n= 1 (количество атомовнов металла), Z = 2 (валентность металла)
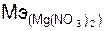 = 148/ 2 = 74 г/моль.
= 148/ 2 = 74 г/моль.
 – оксид алюминия. Расчет ведем по формуле (10):
– оксид алюминия. Расчет ведем по формуле (10):
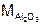 = 27·2 + 16·3 = 102 г/моль; n= 2 (количество металла), Z = 3 (валентность металла)
= 27·2 + 16·3 = 102 г/моль; n= 2 (количество металла), Z = 3 (валентность металла)
 = 102 / 6 = 17 г/моль.
= 102 / 6 = 17 г/моль.
Пример 3. При сгорании металла образуется 9,43 г его оксида.
Молярная масса эквивалента оксида металла равна 17 г/моль. Какая масса металла вступала в реакцию?
Решение. Учитывая, что  , можно найти молярную массу эквивалентов металла:
, можно найти молярную массу эквивалентов металла:  г/моль, по закону эквивалентов формула (4) найдем количество металла, вступившего в реакцию: m (металла) = 9,43×9/17 = 4,99 г.
г/моль, по закону эквивалентов формула (4) найдем количество металла, вступившего в реакцию: m (металла) = 9,43×9/17 = 4,99 г.
Пример 4. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите молярную массу эквивалентов оксида и молярную массу эквивалентов металла.
Решение. Молярная масса водорода равная 2 г/моль при н.у., занимает объем 22,4 л, то объем молярной массы эквивалентов водорода
(1 г/моль) будет равен 22,4: 2 = 11,2 л.
По закону эквивалентов формула (5): 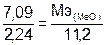
 = 7,09·11,2/2,24 = 35,45 г/моль.
= 7,09·11,2/2,24 = 35,45 г/моль.
Согласно закону эквивалентов 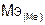 =
=  –
– 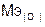 = 35,45 – 8 =
= 35,45 – 8 =
= 27,45 г/моль.
Пример 5. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 мл кислорода (н.у.)?
Решение. Молярная масса кислорода, равная 32 г/моль при н.у., занимает объем 22,4 дм3, то объем молярной массы эквивалентов кислорода (8 г/моль) будет равен 22,4: 4 = 5,6 л = 5600 мл.
По закону эквивалентов формула (5):  ;
;  =
=  .
.
Отсюда  = 310·12,16: 5600 = 0,673 г.
= 310·12,16: 5600 = 0,673 г.
Пример 6. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалентов металла.
Решение. Молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
 .
.
Молярная масса эквивалентов иона (катиона, аниона) равна отношению молярной массы иона к величине заряда иона.
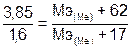 .
.
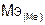 = 15 г/моль.
= 15 г/моль.
 2015-10-22
2015-10-22 4894
4894
