| Вещество | Δ Н°298, кДж/моль | Δ G°298, кДж/моль | S°298, Дж/(моль·К) |
| Ga(к) | 41,1 | ||
| HCl(г) | –91,8 | –94,79 | 186,8 |
| GaCl3(к) | –524,7 | –492,8 | 133,4 |
| Н2(г) | 130,52 |
Данные термодинамические функции относятся к 1 молю вещества и при расчетах должны быть умножены на стехиометрические коэффициенты.
3. Изменение энтальпии химической реакции рассчитываем по формуле (17)
ΔНх.р =  ΔН°298(Н2(г)) + ΔН°298(GaCl3(т)) – ΔН°298(Ga(т)) – 3 ΔН°298(HCl(г)) =
ΔН°298(Н2(г)) + ΔН°298(GaCl3(т)) – ΔН°298(Ga(т)) – 3 ΔН°298(HCl(г)) =
= 0 – 524,7 – 0 – 3(–91,8) = –524,7 + 275,4 = –249,3 кДж/моль.
Для построения энтальпийной диаграммы, определяем сумму энтальпий образования исходных веществ и продуктов реакции отдельно:
∑ΔНобр. исх. в-в = –275,4 кДж; ∑ΔНобр. прод. р-ии = –524,7 кДж (рис. 3).

Рис. 3. Энтальпийная диаграмма
4. В ходе реакции энергия выделяется, 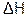 < 0, реакция экзотермическая. Выделение тепла вызывает повышение температуры.
< 0, реакция экзотермическая. Выделение тепла вызывает повышение температуры.
5. Изменение стандартной энтропии химической реакции рассчитываем по формуле (18):
ΔSх.р =  S°298(Н2(г)) + S°298(GaCl3(т)) – S°298(Ga(т)) – 3S°298(HCl(г)) =
S°298(Н2(г)) + S°298(GaCl3(т)) – S°298(Ga(т)) – 3S°298(HCl(г)) =
=  130,52 + 133,4 – 41,1 – 3·186,8 = 195,78 + 133,4 – 560,4 – 41,1 =
130,52 + 133,4 – 41,1 – 3·186,8 = 195,78 + 133,4 – 560,4 – 41,1 =
= 329,18 – 601,5 = – 272,32 Дж/(моль·K).
Уменьшение энтропии в ходе реакции свидетельствует об упорядочении системы – уменьшении числа газообразных молекул и об обратимости данного процесса.
6. Изменение стандартной энергии Гиббса химической реакции рассчитываем по формуле (21):
ΔGх.р =  ΔG°298(Н2(г)) + ΔG°298(GaCl3(т)) – ΔG°298(Ga(т)) – 3ΔG°298(HCl(г)) =
ΔG°298(Н2(г)) + ΔG°298(GaCl3(т)) – ΔG°298(Ga(т)) – 3ΔG°298(HCl(г)) =
=0 – 492,8 – 0 – 3(–94,79) = –492,8 + 284,37 = –208,43 кДж/моль.
По уравнению Гиббса (20):
ΔG = –249,3 – 298·(–272,32·10–3) = –249,3 + 81,15 = –168,15 кДж/моль.
Отрицательный знак изобарного потенциала (ΔG < 0) свидетельствует о возможности протекания реакции в стандартных условиях. Разница в величинах ΔG, рассчитанных двумя путями находится в пределах допустимого (15 %).
7. Поскольку ΔS < 0 и ΔH < 0, т. е. имеют одинаковые знаки, то реакция обратима.
8. Для данной реакции рассчитаем температуру равновесия Тр по формуле (21) и сравним со значением Тр на графике:
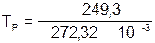 = 915,47 K.
= 915,47 K.
9. Получим зависимость ΔG = f (T), рассчитав величину ΔG при Т = 500, 1000, 1500 К.
Δ G500 = –249,3 – 500·(–272,32·10–3) = –249,3 + 136,16 = –113,14 кДж/моль;
Δ G1000 = –249,3 – 1000·(–272,32·10–3) = –249,3 + 272,32 = 23,02 кДж/моль;
ΔG1500 = –249,3 – 1500·(–272,32·10–3) = –249,3 + 408,48 = 159,18 кДж/моль.
Построим по полученным данным зависимость ΔG = f (T), (рис. 4).
|
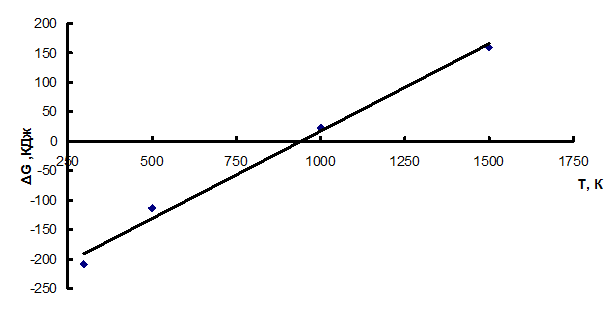
Рис. 4. График зависимости ΔGх.р. = f (T )
10. Вывод: реакция обратимая, экзотермическая, протекает при стандартных условиях и возможна в температурном интервале при значениях ΔG < 0, т. е. при температуре ниже 915,47 К.
 2015-10-22
2015-10-22 2080
2080








