Задание: Дайте термодинамическую характеристику процесса по приведенному плану.
1. Запишите стехиометрическое уравнение.
2. Выпишите термодинамические функции участвующих веществ.
3. Рассчитайте изменение стандартной энтальпии химической реакции и постройте энтальпийную диаграмму.
4. Определите, является реакция экзо- или эндотермической; увеличивается или уменьшается температура в системе в результате протекания данной реакции.
5. Рассчитайте изменение стандартной энтропии реакции, объясните изменение энтропии в ходе реакции.
6. Рассчитайте стандартное изменение энергии Гиббса по балансовому уравнению и уравнению Гиббса. Дайте анализ полученным данным.
7. Сопоставьте знаки величин 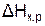 и
и 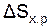 . Сделайте вывод об обратимости реакции.
. Сделайте вывод об обратимости реакции.
8. Для обратимой реакции рассчитайте равновесную температуру согласно уравнению Гиббса, принимая, что предельно допустимой температурой является 3000 К. Сделайте вывод: Тр – реализуема или не реализуема.
9. Рассчитайте величину 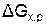 при нескольких значениях температур (500, 1000 и 1500 К) для необратимых реакций и при Т < Тр, Т > Тр – для обратимых реакций. Постройте графическую зависимость
при нескольких значениях температур (500, 1000 и 1500 К) для необратимых реакций и при Т < Тр, Т > Тр – для обратимых реакций. Постройте графическую зависимость 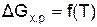 .
.
10. Сделайте вывод о самопроизвольности протекания химической реакции. Определите условия, при которых реакция возможна.
Пример 1. Ga + HCl) ↔ GaCl3(т) + Н2(г).
Решение
1. Записываем стехиометрическое уравнение:
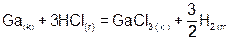 .
.
2. Выписываем стандартные термодинамические функции образования компонентов реакции (табл. 20) (термодинамические параметры веществ представлены в прил. 2).
Таблица 20
 2015-10-22
2015-10-22 1765
1765








