Очевидно, что ЭМИ играет существенную роль в механизмах генерации и действия ЭФ электромагнитной природы в нервной системе человека. В основе ее коммуникативных и сигнальных функций лежит способность нервных клеток генерировать и проводить электрические импульсы. Электрофизику и метаболизм нервной системы и нейронов исследуют с помощью методов ЭКГ, ЭЭГ, МЭГ, ЯМР и позитронно-эмиссионной томографии (ПЭТ), термоэнцефалоскопии, психофармакологии и непосредственным зондированием нервных клеток микроэлектродами. Квантовые магнитометры (СКВИД), в принципе, позволяют регистрировать магнитное поле отдельного нейрона [10, 11]. Явления ЭМИ и резонанса, по-видимому, лежат в основе механизма чувствительности нервной системы к прямым воздействиям внешних ЭМ-излучений различного диапазона. Наличие в нервной системе LC-структур, в принципе, допускает «настройку» чувствительных элементов нервной системы на частоты как внутренних, так и внешних биогенных излучений по принципу гетеродинной связи.
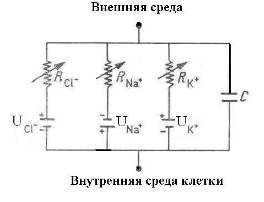 Для объяснения электрических свойств мембраны привлекают схему эквивалентного контура, в которой проводящие каналы для различных ионов моделируют источником ЭДС и омическим сопротивлением (R), а изоляционные свойства мембраны представляют емкостью (Рис 2).
Для объяснения электрических свойств мембраны привлекают схему эквивалентного контура, в которой проводящие каналы для различных ионов моделируют источником ЭДС и омическим сопротивлением (R), а изоляционные свойства мембраны представляют емкостью (Рис 2).
Рис 2. Эквивалентная электрическая модель мембраны нерва: батареи создают суммарный мембраны потенциал U, ионная проводимость обозначена сопротивлениями R, емкость мембраны – конденсатор С [12].
Параллельное соединение нескольких контуров, показанных на Рис 2, моделирует мембрану нейрона [12]. Однако для модели нейрона центральной нервной системы, имеющего миелиновую оболочку, емкостной характеристики мембраны не достаточно. Действительно, в спиральной структуре миелина есть регулярные каналы (насечки) (Рис 3), которые в контексте эквивалентной электрической модели мембраны (Рис 2) вполне могут играть роль локальных катушек индуктивности. Число насечек на одном миелиновом сегменте волокна, тем больше, чем толще осевой цилиндр аксона [13].
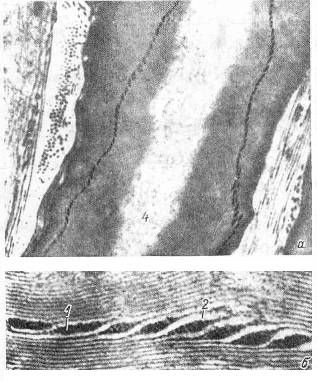
Рис 3. Ультраструктура миелиновой мембраны нерва. а – общий вид насечки; б – увеличенное изображение насечки [13]
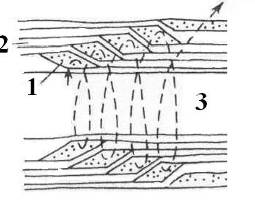
Рис 4. Схема цитоплазматического канала (насечки) (1) в миелиновой оболочке (2) аксона. 3 – аксоплазма [13].
Краевая структура миелиновых оболочек в области перехватов Ранвье образует катушки из спиралей паранодальных петлей длиной порядка 1 мкм, сообщающихся с аксоплазмой через специальные окна. Если эти образования рассматривать как катушки индуктивности (Рис 5 - 7), то они будут играть существенную роль в сальтаторном механизме проводимости аксона.

Рис 5. Электронная фотография перехвата Ранвье, периферийного нерва [17].

Рис 6. Схема строения перехвата Ранвье. 1 – щель перехвата; 2 – мякотный конус; 5 – компактный миелин; 6 – расщепление основных плотных линий в области перехвата; 7 – осевой цилиндр (аксоплазма); 8 – цитоплазма шванновской клетки [13].
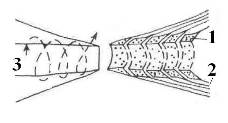
Рис 7. Схема краевых спиралей петлей миелиновой оболочки в области перехвата Ранвье. 1 – цитоплазма; 2 – миелин; 3 – аксоплазма [13].
Различия электродинамических свойств аксоплазмы, мембраны и межклеточной жидкости, обусловленные различием их ионно-молекулярного состава и структуры, должны наложить свой отпечаток на механизм генерации ПД. Стимул, запускающий перезарядку мембраны, может быть как физической, так и химической природы, а само перераспределение зарядов может в той или иной пропорции сочетать перенос ионов через мембрану и их адсорбцию на ее поверхностях [14]. С ионными токами перезарядки поверхности мембраны аксона будут связаны импульсные токи смещения в паранодальных петлях и спиральных каналах насечек, что позволяет их уподобить магнитным диполям [9]. С кинетикой нарастания и последующей релаксации мембранного потенциала коррелирует кинетика ионных токов и токов смещения в аксоне, мембране и паранодальных петлях миелиновой оболочки. Поскольку фаза нарастания ПД длится около 0,1 – 0,2 мс, а время релаксации мембранного потенциала порядка ~1 мс [15], то и импульсные токи смещения, соответствующие фазе нарастания будут на порядок больше токов релаксации. Изменение заряда на внутренней стороне мембраны аксона в области перехвата Ранвье порождает волну поляризации или ток смещения в паранодальной области миелинового сегмента [16]. Величина данного возмущения будет экспоненциально затухать с расстоянием [17], а скорость распространения не превысит скорости движения ПД в немиелизированном нерве (порядка 1 м/с). Наличие окон связи паранодальных петель с аксоплазмой [16] обеспечивает преобразование волны поляризации в кольцевой ток смещения в спиралях петель.
Таким образом, генерирование ПД в перехвате Ранвье сопряжено с индуцированием и излучением-отшнуровкой вихревых ЭМ-квантов, метрику которых моделируют ЭМ-вихри в) и с) на Рис 1. Возможно, что именно в этом и заключается главная функция концевых катушек миелиновых оболочек и спиралей насечек. Направление вектора плотности потока ЭМ-энергии (вектор Пойтинга) будет определяться знаком спирали. Данный фактор хиральности нейрона обеспечит односторонность распространения ЭМ-кванта, а значит, и ПД по миелизированному нерву. При достижении ЭМ-кванта со скоростью V (5) концевой катушки миелинового сегмента он может сыграть роль стимула для генерации ПД в следующем перехвате Ранвье. В данной модели сальтаторной проводимости нейрона скорость движения спайка будет лимитироваться процессом возбуждения тока в концевых катушках, время которого порядка 10–6 c (1 мкм: 1 м/с). При этом средняя скорость передачи ПД с одного конца миелинового сегмента на другой при его длине порядка 100 мкм и определит скорость сальтаторного механизма проводимости ~100 м/с.
Используя значение разности потенциалов, отвечающую ПД типичного нейрона (U ~ 70 мВ [15]), оценим величину электрической энергии, которая затрачивается на возбуждение ПД в перехвате Ранвье при сальтаторном механизме проводимости нейрона. Для этого представим перехват в виде цилиндрического конденсатора, обкладки которого образованы из мембраны нейрона и длина равна длине перехвата (f). Изменение энергии конденсатора (W), можно оценить по формуле:
W = (U2C)/2. (8)
Величина С для цилиндрического конденсатора с расстоянием между обкладками (d) и радиусом внутреннего цилиндра (R) при условии d «R будет равна
С = (2πεoε f)/[ln(1+d/R)] ≈ (2πεoε fR)/d
а величина
W = (U2 πεoε fR)/d (9)
Подставим в (9) такие значения для нерва с R = 5 мкм [17]: U ~ 0,07В; εo = 8,85 10–12 Ф/м; ε ~ 5; f ~ 10–7 м; d ~ 10–8 м, получим
W ~ 510–17 Дж или 3107 Дж/моль. (10)
Такая же величина W получится, если подставить в (8) значение С = 10–2 Ф/м2 [17] при тех же параметрах перехвата Ранвье и величине U. Величина (10) сравнима с энергией, выделяемой при окислении ~10 молекул глюкозы и при гидролизе ~103 молекул АТФ.
Известно [12, 17], что при гидролизе одной молекулы АТФ через мембрану проходят ~3 иона Na+ в обмен на два иона К+, а при возбуждении ПД плотность потока ионов Na+ через мембрану перехвата составляет JNa ~ 4103 ионов/мкм2. Тогда число вошедших в аксон ионов Na+ будет равно JNa (2πRf ) ~ 104, им соответствует ~3103 молекул АТФ, суммарная энергия которых по порядку величины согласуется с (10). При концентрации АТФ в аксоплазме аксона кальмара ~1 ммоль на 1 кг Н2О [12], общее число молекул АТФ в цилиндре перехвата Ранвье (радиуса 5 мкм и длиной 1 мкм) будет равно ~ 4 107 молекул. Следовательно, величина W составит только 0,01% от полного энергетического ресурса перехвата Ранвье.
Очевидно, что энергия ЭМ-кванта, играющего роль стимула генерации ПД в перехвате Ранвье будет на один, два порядка меньше величины W. Например, за верхний предел энергии ЭМ-кванта можно взять энергию фотона с длиной волны 600 нм (4 10–19 Дж), которой достаточно, чтобы возбудить сигнал в рецепторной клетке сетчатки глаза [15].
Нейросети
Подчинение нейрофизики закону ЭМИ можно формализовать, введя в эквивалентную электрическую схему мембраны нерва с миелиновой оболочкой вместе с конденсатором еще катушку индуктивности (Рис 8). Такая модификация эквивалентной схемы, преобразуя ее в колебательный контур, существенно расширяет диапазон электрофизических свойств нейрона.
 Рис 8. Модифицированная электрическая схема мембраны нерва. Rm, U – ионный канал; С – емкость мембраны; L – индуктивность глиальных миелиновых спиралей мембраны; Rin – сопротивление аксоплазмы.
Рис 8. Модифицированная электрическая схема мембраны нерва. Rm, U – ионный канал; С – емкость мембраны; L – индуктивность глиальных миелиновых спиралей мембраны; Rin – сопротивление аксоплазмы.
Помимо этого, введение катушек индуктивности в электрическую схему мембраны нерва позволяет смоделировать фактор хиральности нейрона и связать его с механизмом дифференциации нервных сигналов на возбуждающие и тормозящие. Сочетание фактора хиральности с биохимическим фактором (синаптические связи) наделяет логический элемент нейронных сетей возможностью кодировать сигналы «да» и «нет» (Рис 9).
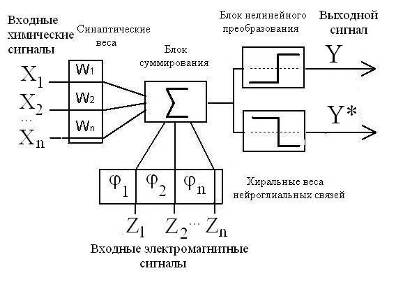
Рис 9. Модифицированная функциональная схема формального нейрона [18]. Хn – биохимические, Zn – электрофизические факторы активности нейрона; Y («да»), Y* («нет») – аналоги возбуждающего и тормозящего сигналов.
Кроме того, генерируемые в нейросети ЭМ-кванты или квазифотоны можно объединить в динамичную квантовую систему (Бозе-газ) и представить мозг процессором, элементной базой которого служит вся совокупность многоуровневой иерархии нейрон-нейронных и нейроглиальных связей. При этом оперативность квантового уровня организации нейросети будет лимитироваться величиной V (5) и время передачи и обработки сигнала в масштабе нейросети от 1 мкм до 10 см будет меняться в диапазоне от 10–15 до 10–10 с. Первое значение сопоставимо с временем жизни синглетного электронно-возбужденного состояния молекулы (оптический квазифотон), а второе с характерным временем жизни тетраэдрических кластеров воды.
 2015-10-22
2015-10-22 1295
1295
