АТОМНАЯ И ЯДЕРНАЯ ФИЗИКА
ЛАБОРАТОРНАЯ РАБОТА
Зеленодольск 2007
Печатается по решению учебно-методической комиссии Зеленодольского филиала КГУ
УДК 537.635; 537.611.43
Методическое пособие к лабораторным работам по атомной и ядерной физике «Рентгеновское излучение». Зеленодольск, 2007
Данное методическое пособие предназначено для студентов третьего курса физико-математического факультета Зеленодольского филиала КГУ, специализирующихся по радиофизике. В нем изложены основы теории, описание установки и методика выполнения лабораторной работы по изучению рентгеновского излучения. Макет лабораторной установки разработан в НИИ Ядерной физики МГУ им. М.В.Ломоносова.
Составители: доц. Изотов В.В. (ЗФ КГУ)
доц. Аникеенок О.А. (ЗФ КГУ)
Дыганов А.Г (ЗФ КГУ)
Рецензент: проф. Садыков Э.К.
(Кафедра физики твердого тела КГУ)
Оглавление.
Глава I Физика явления........................................................................................... 4
§1. Тонкая структура рентгеновских уровней атома………………………….7
Глава II Методы получения и регистрации рентгеновских спектров............. 11
§1. Источники возбуждения рентгеновского излучения................................ 12
§2. Спектрометрические блоки......................................................................... 13
Глава III Учебный лабораторный комплекс Рентгеновский спектрометр (УЛК РС). 15
§1. Приборная часть............................................................................................ 15
§2. Компьютерно - программная часть............................................................. 17
§3. Эксперимент.................................................................................................. 18
§5. Задание........................................................................................................... 31
Литература........................................................................................................... 32
Глава I
Физика явления.
Рентгеновские лучи – это электромагнитное излучение, которое возникает либо при торможении свободно движущейся заряженной частицы, либо при электронных переходах во внутренних оболочках атома. Спектры этих двух видов излучения существенно различаются. В первом случае это тормозной спектр с непрерывным распределением по длинам волн, коротковолновая граница которого обрывается при энергии, равной максимальной кинетической энергии заряженной частицы. Строение тормозного спектра не зависит от материала, на котором происходит торможение заряженной частицы (в рентгеновской трубке это материал анода).
Во втором случае спектр линейчатый. Он зависит от материала, излучающего его, и характеризуется им. Каждый элемент обладает своим, характерным для него линейчатым спектром, поэтому линейчатые рентгеновские спектры называются также характеристическими.
Рентгеновское излучение лежит в диапазоне длин волн примерно от 102 до 10–2 Å, что по энергии фотонов соответствует области от 100 эВ до 1 МэВ. Однако четких границ здесь нет; так, фотоны в синхротронном излучении (тормозном спектре) могут обладать энергией, большей 1 МэВ. Рентгеновский диапазон обычно делится на две части, l < 2Å соответствует жесткому излучению, а l > 2Å – мягкому.
Рентгеновские лучи обладают проникающей способностью, тем более сильной, чем жестче они (чем короче их длина волны). Это свойство послужило причиной широкого использования рентгеновского излучения в различных аппаратах, – от рентгеновского томографа в медицине до приборов количественного элементного анализа высокой точности.
Предлагаемая лабораторная задача посвящена изучению характеристических спектров излучения (эмиссии) различных элементов, поэтому здесь будет кратко описано явление возникновения этих спектров и их свойства.
В нормальном состоянии многоэлектронный атом представляет собой положительно заряженное ядро, окруженное системой электронных оболочек от самой внутренней с главным квантовым числом n=1, до внешней с n, соответствующим данному элементу (максимальное значение n=7 соответствует концу таблицы периодической системы элементов). Оболочки обозначаются буквами K,L,M,N,O,P,Q в соответствии с ростом n, начиная от единицы. На каждой оболочке находится определенное число электронов в соответствии с принципом Паули. Следует отметить, что понятие “оболочка” более соответствует энергетическому понятию (которое можно заменить термином “уровень энергии”), чем координатному. В соответствии с квантовой механикой электроны в атоме как бы “размазаны” по объему с максимумом вероятности локализации на оболочке. В то же время в энергетическом пространстве наблюдается более четкое разделение между оболочками - уровнями энергии, хотя и здесь наблюдается определенное их перекрывание.
В нормальном состоянии атом не излучает и не поглощает энергию. Излучение, связанное с переходами во внутренних оболочках возможно лишь в случае, когда один или несколько внутренних электронов будут удалены. Любой электрон, принадлежащий внешней (по отношению к образовавшейся вакансии – “дырке”) оболочке, оказывается возбужденным. Это приводит к переходам с более высоких уровней на уровень вакансии с излучением рентгеновского кванта.
Если выбит K-электрон, то переходы на образовавшуюся вакансию с выше лежащих L,M,N... уровней образуют наиболее коротковолновую K- серию излучения. Аналогичный процесс наблюдается при переходах на вакансии L-уровней (L-серии), вакансии M-уровней (M-серии) и т.д.

Рис 1. Схема рентгеновских уровней и переходов, образующих K, L, M, N серии. Kгр, Lгр, Mгр, Nгр - границы серий, соответствующие переходам в непрерывный спектр. n - главное квантовое число.
Разность энергий конечного ( ) и начального (
) и начального ( ) уровней равна энергии Е = hn = ç
) уровней равна энергии Е = hn = ç  -
-  ç фотона, испускаемого при переходе из начального i-го в конечное f-е состояние и соответствует спектральной линии частоты n.
ç фотона, испускаемого при переходе из начального i-го в конечное f-е состояние и соответствует спектральной линии частоты n.
Внутренний электрон атома находится в экранированном кулоновском поле и его состояние очень похоже на состояние электрона водородоподобного иона. Разница состоит в том, что находится он не в поле с зарядом Ze, а в поле с эффективным зарядом Zэфe=(Z – a 1)e, где a 1 - постоянная полного экранирования.
Выражение для энергии внутреннего электрона может быть представлено формулой, подобной формуле для атома водорода, но с эффективным зарядом (Z – a 1) e.
 . (1)
. (1)
Энергия фотона излучения, соответствующая переходу этого электрона в нижнее вакантное состояние, равна
 =
=  (2)
(2)
Здесь Ry = 13,6 эВ (Ридберг) - величина, равная потенциалу ионизации атома водорода, a 1f и a 1i - постоянные полного экранирования конечного состояния f и начального i, nf и ni -соответствующие главные квантовые числа.
Как отмечалось выше, согласно квантовой механике, электрон в состоянии с квантовым числом n можно с большой степенью вероятности найти, на характерном для данного n расстоянии rn от ядра (т.е. в пределах слоя, определяемого нами как оболочка). Однако существует конечная вероятность обнаружить его как внутри, так снаружи оболочки. Это приводит к тому, что в формировании постоянной a 1 принимают участие все электроны атома. Теоретическое вычисление a 1 представляет сложную задачу, и обычно для ее определения используют экспериментальные данные.
Постоянные a 1i,f - зависят от главного квантового числа n и орбитального квантового числа l.
Так, например, в церии (Z=58) для K оболочки (n=1) a 1K=3,5; а для L оболочки (n=2) a 1L=15,5. Наблюдается также незначительный рост этой величины с увеличением Z.
Несмотря на то, что a 1i,f существенно зависит от n, разность в формуле (2)
 (3)
(3)
можно заменить на
 (4)
(4)
где постоянные экранирования a 1 одинаковы и не равны a 1i,f. Подчеркнем, что a 1 имеет смысл некой условной средней постоянной экранирования. Эта величина также зависит от n, l и Z. Так для  линий элементов с атомными номерами 20 < Z < 30 значение a 1 = 1,13, а для
линий элементов с атомными номерами 20 < Z < 30 значение a 1 = 1,13, а для  линий и Z ³ 62: a 1 = 7,9.
линий и Z ³ 62: a 1 = 7,9.
Проведенное преобразование приводит выражение (2) к виду
Е=hn=(Z- a 1)2Ry( ), (5)
), (5)
которое в форме
 (6)
(6)
или
 (7)
(7)
известно как Закон Мозли.
В формуле (7) k - волновое число (k = 1/l), R - постоянная Ридберга (R=1,09678×105 см-1). Выражения (6) и (7) демонстрируют линейную зависимость квадратного корня из энергии фотона от атомного номера Z.
Из выражения (1) видно, что закону Мозли подчиняется также и энергия уровня. Следует подчеркнуть, что закон Мозли не точный. Отклонения от линейности наблюдаются с ростом Z и длины волны рентгеновского излучения.

Рис. 2 Диаграммы Мозли для K и L серий.
Тонкая структура рентгеновских уровней атома.
Изучение спектральных линий приборами с высокой разрешающей способностью показало, что линии имеют тонкую структуру. Как спектральные линии, так и уровни энергии в действительности состоят из набора тесно расположенных компонентов. Это явление обусловлено релятивистской зависимостью массы электрона от скорости и взаимодействием собственного магнитного момента электрона с орбитальным магнитным моментом, называемым спин-орбитальным взаимодействием. Энергия этого взаимодействия существенно меньше энергии взаимодействия электрона с ядром (формула (1)). Учет спин-орбитального взаимодействия и релятивистской зависимости массы электрона от скорости приводит к дополнительному слагаемому в формуле (1), которое зависит не только от квантовых чисел n и l, но и от внутреннего квантового числа j
 (8).
(8).
Здесь Ry =13,595 эВ, a=2pe2/hc=7,297×10-3 - постоянная тонкой структуры; j =ï l ±sï=ï l ±1/2ï (l - орбитальное квантовое число, принимающее значения l =0, 1, 2,...n-1; s =1/2 - спиновое квантовое число электрона).
Разницу между первым и вторым членом в квадратных скобках формулы (8) в основном определяет множитель a2 (Z – a 2)4. Если первый член для L-оболочки в средней части таблицы элементов составляет величину ~ (3 ‑ 4) кэВ, то второй ~ (0,2 ‑ 0,3) кэВ.
Рассмотрим изменение структуры уровней энергии в результате учета спин-орбитального взаимодействия. Энергия K-оболочки (n=1), или K-уровень несколько изменит свое положение из-за учета релятивистской зависимости массы электрона от скорости, но не расщепится. Это связано с тем, что при l =0 магнитный орбитальный момент электрона равен нулю (магнитного орбитального поля нет) и, следовательно, собственные магнитные моменты электронов каждого атома направлены хаотически и их среднее значение равно нулю. Таким образом, S-термы (l =0) всегда синглетны. Напротив, P (l =1), D (l =2), F (l =3) и т.д. термы всегда дублетны, т.к. спин электрона может принимать направления в среднем по или против орбитального магнитного поля, которое создается движением электрона по орбите.
Эти же результаты можно получить, если во втором члене формулы (8) подставить значения j, соответствующие возможным значениям l при заданном n. В результате мы увидим, что, исключая K оболочку, L оболочка расщепится на три уровня LI, LII и LIII, для которых соответственно l =0 (s-термы синглетны, LI) и l =1 (p-термы дублетны, LII и LIII), M оболочка расщепится на пять уровней MI, MII, MIII, MIV и MV и т.д. Схема уровней представлена на рис.3.
Энергия спин-орбитального взаимодействия в основном зависит от электронной плотности вблизи ядра, поэтому эффективный заряд ядра определяется внутренними по отношению к данной оболочке электронами. В результате постоянная экранирования a 2 < a 1. Постоянная a 2 называется постоянной внутреннего экранирования. Она не зависит от Z и растет с увеличением n и l, так для n=2 a 2=3,5; для n=3 и l =1 a 2=8,5; а для n=3 и l =2 a 2=13.
Согласно правилам отбора в дипольном приближении для одноэлектронных (здесь однодырочных) атомов переходы возможны при условиях
D l = ±1 Dj = 0, ±1 (9)
На рис.3 представлена диаграмма переходов линий с принятыми в рентгеновской спектроскопии обозначениями. Следует иметь в виду, что эти правила нарушаются, и в спектре наблюдаются слабые линии, соответствующие электрическим квадрупольным переходам Dl= 0, ±2, Dj= 0, ±1, ±2, а также магнитным дипольным переходам.
Расположение K, L, M…уровней, как и расстояния между подуровнями (LIII-LII, LII-LI, MII-MI, и т.д.), представленные на схеме, никак не отражает действительных соотношений. Так расстояние между K и L уровнями в 8-10 раз больше, чем расстояние между L и M уровнями, а расщепление L уровней более чем на порядок превосходит расщепление М уровней. В результате рентгеновские спектры представляют собой значительно разнесенные между собой группы линий, каждая из которых представляет собой соответствующую серию – K, L, M…

Рис.3 Диаграмма рентгеновских K и L серий с учетом тонкой структуры.
Для получения правильного представления о количественных соотношениях приведем пример спектра Zr-циркония (Z = 40), расположенного в средней части таблицы Менделеева. В таблице приведены в единицах энергии кэВ наиболее интенсивные спектральные линии.
| LIII - серия | LII - серия | LI - серия | K- серия | ||||||||
 |  |  |  |  |  |  |  |  |  |  |  |
| 2.040 | 2.042 | 2.219 | 2.124 | 2.302 | 2.187 | 2.201 | 15.688 | 15.772 | 17.654 | 17.6678 | 17.970 |
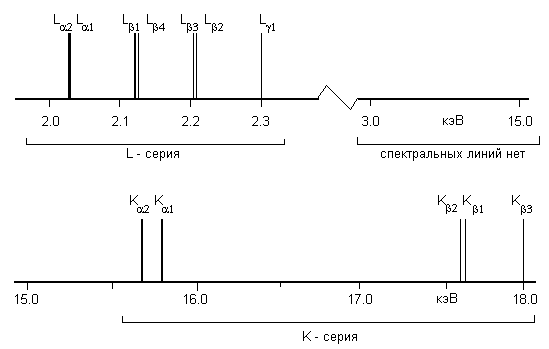
Рис.4 K и L – серии циркония.
Количественный анализ рентгеновских спектров указывает на то, что требования к спектральным приборам при исследовании разных серий должны существенно различаться.
Глава II
Методы получения и регистрации рентгеновских спектров
Как уже отмечалось, для возбуждения рентгеновского характеристического излучения необходимо удалить электрон (электроны) из внутренних оболочек атома исследуемого образца. Это можно осуществить разными способами: рентгеновским излучением (фотонными пучками), ионными и электронными пучками, источниками радиоактивного излучения быстрых частиц (например, альфа-частиц) и, наконец, за счет процессов взаимодействия атомных электронов с ядром.
Каждый из перечисленных методов имеет свои преимущества и недостатки, имеющие значение для профессиональных исследований. Здесь мы кратко опишем лишь те, которые используются в нашем приборе.
После возбуждения тем или иным методом характеристического излучения исследуемого образца (такой спектр называется спектром флуоресценции) производится его спектральный анализ. Спектральный анализ может быть осуществлен кристалл-дифракционным спектрометром (КДС) или полупроводниковым детектором (ППД).
Рассмотрим более подробно отдельные узлы установки.
 2017-11-01
2017-11-01 1511
1511







