Запишем математическое выражение первого начала термодинамики для простой системы в двух формах (2.12) (с использованием внутренней энергии и энтальпии) в развёрнутом виде с учётом полных дифференциалов для внутренней энергии (2.10) и энтальпии (2.19) и определения количества теплоты (1.31):
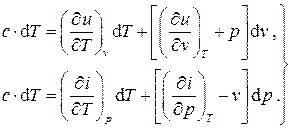 (2.20)
(2.20)
Будем поддерживать постоянным объём системы, т.е. положим 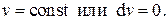 Такой процесс называется изохорным. Тогда, т.к. теплоёмкость системы зависит от процесса, следует положить
Такой процесс называется изохорным. Тогда, т.к. теплоёмкость системы зависит от процесса, следует положить  . Из первого уравнения (2.20) получаем
. Из первого уравнения (2.20) получаем
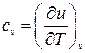 , (2.21)
, (2.21)
т.е. теплоёмкость при постоянном объёме есть изменение внутренней энергии системы при изменении температуры на единицу при поддержании постоянным её объёма. Таким образом, если имеется независимый способ измерения изменения внутренней энергии тела, то теплоёмкость при постоянном объёме определяется экспериментально. Одним из таких независимых способов является, например, измерение джоулева тепла при протекании постоянного электрического тока через сопротивление.
Аналогичным образом, рассмотрев изобарный процесс, т.е. процесс при постоянном давлении, 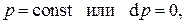 получим определение теплоёмкости при постоянном давлении:
получим определение теплоёмкости при постоянном давлении:
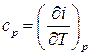 , (2.22)
, (2.22)
т.е. теплоёмкость при постоянном давлении есть изменение энтальпии тела при изменении температуры на единицу при поддержании постоянным давления.
На основании (2.20) теплоёмкость произвольного термодинамического процесса может быть записана в двух эквивалентных формах:
 (2.23)
(2.23)
То, что теплоёмкость зависит от процесса, следует из того, что в этих выражениях мы имеем отношения дифференциалов (изменений) двух независимых параметров состояния, которые могут быть произвольными в зависимости от того, как будет организован процесс. Обсудим далее первый закон термодинамики в применении к идеальному газу.
 2017-10-25
2017-10-25 724
724








