Из определений (2.21) и (2.22) находим теплоёмкости при постоянном объёме и при постоянном давлении для идеального газа
 . (2.31)
. (2.31)
Получаемая отсюда разность теплоёмкостей
 (2.32)
(2.32)
представляет собой известную формулу Майера, а их отношение
 (2.33)
(2.33)
называется показателем адиабаты и, как легко видеть, определяется только числом степеней свободы молекул, т.е. атомностью газа. Результаты расчёта показателя адиабаты для идеального газа на основании молекулярно-кинетической теории представлены в табл.2.1.
Таблица 2.1
| Газ | 1 – атомный | 2 – атомный | 3 – и более атомный |
| Число степеней свободы f | |||
| Показатель адиабаты k |  | 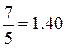 | 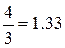 |
Вычисленные по формулам (2.31) значения теплоёмкостей для различных газов сравнительно хорошо совпадают с экспериментально измеренными их значениями в области комнатных температур, которые можно найти в справочной литературе. Расхождение с экспериментом становится существенным при повышении температуры. Эксперимент показывает, что теплоёмкости газов заметно возрастают с увеличением температуры, тогда как рассмотренная выше упрощённая теория даёт для них постоянные значения. Объясняется это расхождение несколькими причинами. Главной причиной расхождения теории с экспериментом является то, что при получении выражения для внутренней энергии газов мы не принимали во внимание квантовые эффекты, учёт которых приводит к тому, что число вращательных и колебательных степеней свободы молекул перестаёт быть постоянной величиной, а зависит от энергии столкновения молекул, т.е., в среднем, от температуры. Кроме того, с увеличением температуры многоатомные молекулы частично диссоциируют, т.е. химический состав газа может заметно измениться.
Из формулы Майера (2.32) и определения показателя адиабаты (2.33) могут быть теоретически найдены удельные теплоёмкости  для идеального газа в классическом приближении:
для идеального газа в классическом приближении:
 . (2.34)
. (2.34)
Таким образом, в случае идеального газа для внутренней энергии и энтальпии имеем
 (2.35)
(2.35)
Итак, внутренняя энергия и энтальпия определены с точностью до произвольных постоянных. Обычно энтальпия выбирается равной нулю при температуре 0оС. Тогда, используя связь между энтальпией и внутренней энергией (2.11) и термическое уравнение состояния идеального газа (1.46), получим
 , (2.36)
, (2.36)
где t измеряется в оС, T 0=273.15 К.
 2017-10-25
2017-10-25 821
821








